
Medián prežívania pacientov s agresívnymi nádormi sa napriek pokrokom v štandardnej liečbe a novým liekom za posledné dve dekády nezmenil. Ide o také nádory ako glioblastómy, pokročilé ovariálne nádory, melanómy, nádory pankreasu či nádory obličiek. Ako vysvetľuje doc. Ing. Čestmír Altaner, DrSc. (Ústav experimentálnej onkológie SAV, BMC a Onkologický ústav sv. Alžbety, s. r. o., Oddelenie prípravy kmeňových buniek), je to spôsobené tým, že tieto nádory obsahujú nádor iniciujúce bunky, ktoré sú rezistentné na rádioterapiu, toxickú chemoterapiu – liečebné modality, ktoré sú základom súčasnej štandardnej terapie.
„Ani tzv. biologická liečba nasmerovaná pomocou liečiv založených na monoklónových protilátkach nepriniesla dlho očakávaný zvrat k lepšiemu výsledku v liečbe solídnych nádorov napriek veľkej finančnej náročnosti.“ Tím pod vedením Čestmíra Altanera sa zaoberá projektom Štúdium využitia exozómov so samovražedným génom produkovaných ľudskými mezenchýmovými kmeňovými bunkami na cielenú liečbu nádorov, ktoré nemajú adekvátnu liečbu.
Liečba nádorov sa podľa neho prirovnáva k mytologickej legende o Trójskom koňovi, z ktorého bojovníci ľsťou vnikli do Tróje a tak ju dobili. „Výhodou tohto prístupu k terapii nádorov oproti bunkovej terapii je niekoľko. Samovražedné exozómy ako veľmi malé častice prenikajú organizmus a sú nasmerované len na nádorové bunky.“ Schematický rozdiel medzi štandardnou chemoterapiou a terapiou prostredníctvom exozómov s dôsledkami pre pacienta je znázornený na nasledujúcom obrázku.
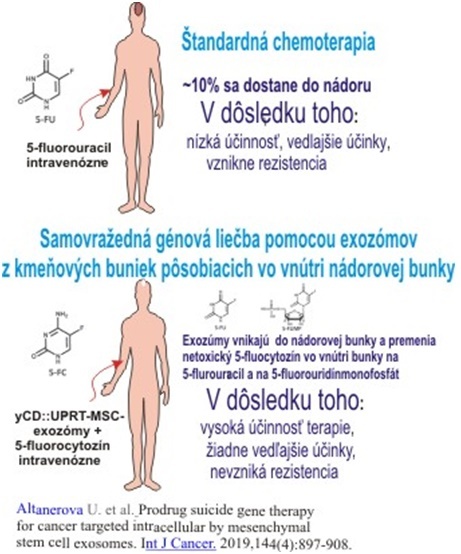
Odborník popisuje, že v ľudskom tele sa nachádzajú mezenchymové kmeňové/stromálne bunky (MSCs), ktorých úlohou je celoživotne sa starať o obnovu poškodených a opotrebovaných tkanív. „Zistilo sa, že túto funkciu vykonávajú sprostredkovane pomocou vylučovania nanočastíc – exozómov s veľkosťou od 30 do 120 nm. Tieto nanočastice vplyvom mikroprostredia poškodených tkanív indukujú vlastnú regeneračnú schopnosť a určujú, ako sa veľmi rozdielne druhy poškodenia budú opravovať. So zvyšovaním veku človeka sa ich schopnosť opravy znižuje, a preto sa tieto bunky stali predmetom intenzívneho výskumu ich využitia v regeneračnej medicíne. Ľudské mezenchýmové kmeňové/stromálne bunky rozpoznávajú nádor ako poškodenie, a preto bunky majú schopnosť migrovať k nádoru. MSCs putujú k miestu nádoru a stávajú sa súčasťou stromy.“
MSCs vedcov inšpiroval vyvinúť cielenú predliečivovú génovú terapiu sprostredkovanú pomocou MSCs upravených na expresiu samovražedných génov. Konkrétne, pripravili MSCs exprimujúce cytozín deaminázu::uracil fosforibosyltransferázu kvasinkového pôvodu (yCD::UPRT ). „Tieto bunky sú schopné konvertovať netoxický 5-fluorocytozín (5-FC) na účinné cytotoxické liečivo 5-fluorouracil (5-FU) a 5-fluorouridin monofosfát, ktoré sa zabudujú do RNA a DNA nádorovej bunky, čo spôsobí nenávratnú smrť nádorovej bunky. V sérii článkov v špičkových časopisoch sme ukázali, že táto predliečivová génová terapia sprostredkovaná pomocou MSCs efektívne inhibovala rast ľudského kolorektálneho karcinómu, melanómu a karcinómu prostaty na nahých myšiach. Ukázali sme aj, že MSCs izolované z tuku modifikované na expresiu génu yCD::UPRT indukujú kuratívny terapeutický efekt na značnom počte potkanov s intrakraniálnym glioblastómom. Významným pokrokom v našom výskume bolo naše zistenie, že MSCs transdukované yCD::UPRT génom uvoľňujú exozómy, ktoré obsahujú m-RNA samovražedného génu vo svojom kargu. Tieto exozómy migrujú k nádorom rovnako ako MSCs a internalizujú sa do nádorových buniek, čím zabijú nádorovú bunku vnútrobunkovou konverziou predliečiva 5-fluorocytozínu na cytotoxické liečivo 5-fluorouracil,“ popisuje doc. Ing. Čestmír Altaner, DrSc.
Toto zistenie publikovali vo špičkovom onkologickom časopise Int. J. Cancer v tomto roku.
Opísané zistenia sú výsledkom práce kolektívu pracovníkov Ústavu experimentálnej onkológie SAV BMC a Onkologického ústavu sv. Alžbety s výraznou finančnou podporou Ligy proti rakovine zdôrazňuje Čestmír Altaner
V súčasnosti je hlavná výskumná pozornosť tímu okolo Čestmíra Altanera zameraná na predklinické štúdie experimentálnej liečby glioblastómu. „Glioblastóm (GBM) je najzhubnejší typ ľudských nádorov mozgu. Vzniká malígnou transformáciou gliových kmeňových buniek. Nádorové gliomové bunky veľmi agresívne prerastajú medzi zdravé bunky mozgu a nádor sa rýchlo šíri. Postihuje dospelých ľudí všetkých vekových kategórií. Medián prežívania pacientov diagnostikovaných s gliómom s WHO gradingom III a IV je iba 8 až 15 mesiacov. Základné liečebné postupy sú operácia a následná konkomitantná rádio chemoterapia. Prognóza pacientov s nádormi vysokého stupňa je veľmi nepriaznivá. Inovatívna liečba nádorov mozgu je urgentne potrebná.“
Odborný garant textu a fotografie poskytol: doc. Ing. Čestmír Altaner, DrSc., emeritný člen Učenej spoločnosti Slovenska
Spracovala: Slávka Cigáňová (Habrmanová), NCP VaT pri CVTI SR
Uverejnila: VČ








