Kľúč k dlhovekosti našli odborníci prekvapivo aj v strese.

Ilustračné foto. Zdroj: iStockphoto.com
Prečítajte si viac o vedkyni
Vedeli ste, že starnutie človeka sa odborne nazýva senescencia? Nie je chorobou, ale prirodzeným biologickým procesom prebiehajúcim pri väčšine živých organizmov. Možno ho prirovnať k zložitému biologickému programu, podľa ktorého je dĺžka ľudského života geneticky až na 35 percent vopred predurčená.
O význame genetickej predispozície a jej vplyvu na proces starnutia svedčí tiež existencia génov zodpovedných za dlhovekosť, ale aj génov zodpovedných za urýchľovanie procesu starnutia a podmieňujúcich ochorenia, akými sú syndrómy predčasného starnutia: Hutchinson-Gilfordov (takzvaná predčasná progeria) a Wernerov syndróm (takzvaná progeria dospelých). Až na výnimky (napríklad nezmar) väčšina tvorov, ktoré obývajú planétu Zem, nie je nesmrteľných, ale zostarne a umiera. Popri kategórii organizmov s priemernou dĺžkou života môžu iné patriť buď do kategórie dlhovekých, alebo krátkovekých organizmov.
Počuli ste už o zdravom starnutí?
Snaha človeka o udržanie mladosti a spomalenie procesu starnutia vždy fascinovala nielen laikov, ale aj výskumníkov. Cieľom moderného výskumu, nasmerovaného do oblasti zdravého starnutia, je odhaliť a „zmapovať“ zmeny, ktoré pribúdajú v ľudskom tele s postupujúcim vekom, objasniť základné princípy a mechanizmy biologického starnutia (prostredníctvom ktorých sa nielen realizuje, no často i urýchľuje starnutie človeka) a získané poznatky prakticky využiť v boji proti starnutiu, obrazne povedané, pri hľadaní elixíru mladosti.
Objasňovanie procesov spojených s biológiou starnutia pomáha odborníkom pristúpiť k takým zásadným zmenám pri zámernom ovplyvňovaní dôležitých vonkajších faktorov ovplyvňujúcich senescenciu – napríklad životného štýlu a liečebných postupov – tak, aby si ľudia mohli udržať pevné zdravie a zostať i v starobe „mladými“. Teda „elixír mladosti“ nájdeme v zdravom starnutí.
Príkladom stimulácie zdravého starnutia je tiež fungovanie Centra aktívneho starnutia, ktoré sa nachádza v areáli Fakulty telesnej výchovy a športu Univerzity Komenského v Bratislave. Vďaka medzinárodnému projektu na výstavbu tohto kompetenčného centra pre pohybovú aktivitu, prevenciu a podporu zdravia seniorov (spolufinancovaného z Európskeho fondu regionálneho rozvoja) sú mnohí bratislavskí seniori – klienti tohto centra – dostatočne pripravení na radikálnu zmenu životosprávy a pohodové zdravé starnutie.
Ako možno experimentálne skúmať procesy starnutia a zasahovať do nich?
Pri vedeckých výskumoch zameraných na starnutie človeka odborníci prekvapivo využívajú rôzne modelové objekty vrátane bunkových kultúr, organoidov, zvieracích a dokonca aj matematických modelov. Pomocou modelových objektov odborníci študujú a objasňujú procesy, pomocou ktorých sa bunky v ľudskom tele špecializujú/diferencujú, regulujú svoje gény, navzájom komunikujú a bránia sa voči chorobám a starnutiu.
Ukázalo sa, že starnutie je proces zapríčinený viacerými faktormi, jednak pôsobiacimi vnútri buniek človeka, jednak vyvolaný vonkajšími faktormi (napríklad infekciami, zápalmi) ovplyvňujúcimi telo človeka ako celok. Napriek tomu, že je tento proces geneticky podmienený, na rýchlosť starnutia majú rozhodujúci vplyv epigenetické procesy/mechanizmy kontrolujúce aktivitu všetkých génov. Tie môžu byť ovplyvňované faktormi prostredia (vrátane klimatických zmien), ktoré prakticky spolurozhodujú o zapínaní alebo vypínaní génovej aktivity živých organizmov.

Morské hviezdice dokážu omladzovať svoje tkanivo. Zdroj: iStockphoto.com
Ako starnú a ako sa regenerujú bunky človeka ?
Bunky sú základnými stavebnými jednotkami živých organizmov vrátane človeka. V ľudských bunkách dochádza po každom delení k skracovaniu koncových úsekov chromozómov, takzvaných telomér, až na takzvanú kritickú dĺžku, pri ktorej sa bunky prestanú deliť. Spolu s poškodzovaním biologických makromolekúl (DNA, proteínov, sacharidov a lipidov) pôsobením voľných radikálov (vysokoefektívnych foriem kyslíka a dusíka) dochádza v bunke k akumulácii porúch. Výsledkom ich nadmernej akumulácie je stav, pri ktorom sa v ľudských bunkách začnú objavovať typické znaky starnutia.
Jestvujú aj výnimky? Áno. Sú to napríklad morské hviezdice. Ak sa rozmnožujú nepohlavne, klonovaním, dochádza dokonca k omladeniu ich tkaniva. Je zaujímavé, že na rozdiel od človeka sa teloméry hviezdic vôbec pri delení buniek neskracujú, ale, naopak, sa predlžujú.
Ale vráťme sa k realite týkajúcej sa človeka! V celom ľudskom organizme postupne dochádza k hromadeniu senescentných/starnúcich buniek a k celkovému vyčerpaniu zásob takzvaných kmeňových buniek. (Kmeňové bunky sú nediferencované/nešpecializované bunky, ktoré majú schopnosť sa premeniť/diferencovať na iný, špecializovanejší druh buniek. Táto schopnosť umožňuje telu vytvoriť nové bunky a nahradiť tak špecializované tkanivá, ktorých bunky sa už nedokážu deliť).
Dôležitá stratégia boja proti starnutiu sa preto musí odohrávať hlavne na bunkovej úrovni. Ako môže tento boj prebiehať? Odpoveď je neočakávaná a prekvapujúca, lebo sa často realizuje aj pomocou stresu, akým je chlad alebo hladovanie. Ak sú bunky vystavené slabému stresu, mechanizmy vyvinuté evolúciou im umožnia vstúpiť do takzvaného „stand-by“ stavu, teda akéhosi systému ich obnovy/reparácie. Ten predĺži život bunky i celého organizmu.
Aké gény sú zodpovedné za dlhovekosť?
Jednoznačne sa podarilo dokázať, že s rastúcim vekom človeka sa mení expresia mnohých génov, a to nielen génov urýchľujúcich, ale tiež odďaľujúcich starnutie, respektíve génov podmieňujúcich dlhovekosť. Okrem génov kódujúcich takzvané sirtuíny za zmienku stojí aj forma génu (alela), zvaná epsilon 2, kódujúca apolipoproteín E (multifunkčný proteín hrajúci dôležitú úlohu v metabolizme lipidov) a vyskytujúca sa hlavne u storočných ľudí. Je zaujímavé, že alela epsilon 4 génu kódujúceho syntézu apolipoproteínu E zasa zvyšuje riziko kardiovaskulárnych ochorení a Alzheimerovej choroby, takže u storočných seniorov by sme ju darmo hľadali.
Vedci identifikovali rodinu siedmich cicavčích génov, ktoré hrajú zásadnú úlohu v systéme obnovy buniek, a preto sa považujú za najdôležitejšie gény zodpovedné za dlhovekosť človeka. Hovorí sa im SIRT gény. Sú zodpovedné za produkciu sirtuínov, t. j. bielkovín/enzýmov nevyhnutných pre prežívanie všetkých živých buniek a organizmov. Sirtuíny boli pôvodne nájdené v kvasinkách, no v súčasnosti je známe, že sa nachádzajú aj v baktériách a eukaryotoch vrátane cicavcov. Sirtuíny sú zázračnými bielkovinami, ktoré odďaľujú starnutie buniek a predlžujú život organizmu prostredníctvom regulácie viacerých bunkových procesov.
Medzi potraviny, ktoré obsahujú sirtuínové aktivátory, patria: čierne ríbezle, kakao, datle, zelený čaj, kel, cibuľa, olivy, kurkuma, vlašské orechy, extra panenský olivový olej, petržlen, tofu a iné sójové produkty. Konzumáciou týchto potravín sirtuíny znižujú reprodukčnú aktivitu bunky, a tak sústreďujú všetky bunkové energetické zdroje na jej prežitie. V súčasnosti možno ľudské sirtuíny považovať za sľubné terapeutické nástroje v boji proti starnutiu a chorobám súvisiacim so starnutím.

Reťazec DNA. Zdroj: iStockphoto.com
Syndrómy predčasného starnutia sú podmienené mutáciami génov
Známe sú však aj gény zodpovedné za skrátenie života človeka. Sú to napríklad tie, ktoré spôsobujú závažné dedičné ochorenia. Hutchinson-Gilfordov syndróm a Wernerov syndróm sú ochorenia súvisiace s urýchľovaním starnutia. Syndrómy predčasného starnutia (predčasná progeria a progeria dospelých) patria medzi zriedkavé geneticky podmienené ochorenia. Vznikajú na základe mutácií v ľudskom genóme (súbor všetkých génov) spôsobujúcich skrátenie života postihnutého jedinca. Doba nástupu choroby/syndrómu je rôzna, a preto nazývame syndróm buď predčasnou progeriou, alebo „adultnou“, resp. prejavujúcou sa v dospelom veku.
Hutchinson-Gilfordov syndróm, predčasné starnutie
Chorobu možno diagnostikovať už u detí, ktoré majú iba niekoľko mesiacov. Naplno sa prejaví medzi 18. a 20. rokom života príznakmi typickými pre proces starnutia (vypadávanie vlasov, problémy s videním, stuhnuté kĺby, degenerácia svalovej hmoty, ateroskleróza a infarkt). Detský pacient preto zodpovedá svojím výzorom seniorom, ktorí dosiahli vek 80 rokov. Pacient s týmto syndrómom sa dožíva maximálne 20 rokov, priemerne však umiera okolo 13. – 15. roku života. Najčastejšími príčinami úmrtia sú cievna mozgová príhoda alebo infarkt myokardu. Je spôsobená mutáciou v géne LMNA, pri ktorej vzniká zvláštna forma proteínu lamínu A, takzvaného progerínu, ktorý sa nachádza v bunkových jadrách a zapríčiňuje narušenie tvaru, štruktúry a funkcií (syntéza RNA a DNA) bunkových jadier. Samotné slovo progeria pochádza z gréčtiny a znamená predčasne starý. Choroba bola po prvý raz opísaná vo Veľkej Británii na konci 19. storočia.
Wernerov syndróm – predčasné starnutie dospelých
Je pomenovaný podľa nemeckého vedca Otta Wernera. Toto dedičné ochorenie je spôsobené mutáciou v géne WRN, ktorý kóduje enzým helikázu podieľajúci sa na oprave molekuly DNA. Postihnutí jedinci zvyčajne rastú a vyvíjajú sa normálne až do puberty. Naplno sa choroba prejavuje vo vyššom veku. Pacienti sa dožívajú 47 – 48 rokov. Hlavnými príčinami ich smrti sú kardiovaskulárne ochorenia a rakovina.
Ako sa líšia dlhoveké a krátkoveké druhy?
Výskumníci z Rochesterskej univerzity zistili, že dlhoveké organizmy sa väčšinou vyznačujú nízkou expresiou/aktivitou génov zapojených do energetického metabolizmu a zápalových procesov a vysokou expresiou génov zapojených do procesov opravy nositeľa genetickej informácie – DNA. Efektívnejšia oprava DNA a slabšia zápalová reakcia sú teda charakteristické pre cicavce s dlhou životnosťou. Pri krátkovekých druhoch je to naopak. Vyznačujú sa vysokou expresiou génov zapojených do energetického metabolizmu a zápalových procesov a nízkou expresiou génov zapojených do opravy DNA.
Keď vedci analyzovali mechanizmy, ktoré regulujú expresiu týchto génov, zistili, že gény negatívne vplývajúce na dĺžku života, sú riadené takzvanými cirkadiánnymi rytmami. Cirkadiánny systém reguluje biologické rytmy počas periódy trvajúcej približne 24 hodín a synchronizuje ich s vonkajšími podmienkami. Jednoducho povedané, cirkadiánny rytmus zahŕňa cykly, ktoré prebiehajú v ľudskom tele počas 24 hodín. Vyvoláva fyzické a duševné zmeny v tele človeka vrátane bdelosti a spánku. Niektoré vonkajšie alebo vnútorné vplyvy však môžu do tohto prirodzeného rytmu zasiahnuť tak, že vedú k poruchám spánku alebo iným zdravotným problémom. Expresia génov, ktoré negatívne ovplyvňujú dĺžku života (tie, ktoré sa podieľajú na energetickom metabolizme a zápale), je u človeka spravidla obmedzená na určitú dennú dobu.
Na druhej strane gény pozitívne vplývajúce na dĺžku života sú riadené schopnosťou, respektíve fenoménom, ktorý sa odborne nazýva pluripotencia (schopnosť obnovy/regenerácie a schopnosť diferenciácie/špecializácie na viac iných typov buniek). Pluripotencia umožňuje preprogramovanie telových/somatických buniek na zárodočné/embryonálne bunky, ktoré môžu organizmus ľahšie omladiť a regenerovať. Zistenie vedcov z Rochesterskej univerzity, že počas evolúcie došlo k aktivovaniu pluripotentných mechanizmov na to, aby sa dosiahla dlhšia životnosť organizmov, môže pripraviť pôdu pre nové stimuly v boji proti starnutiu, a to aktiváciou kľúčových génov pozitívne ovplyvňujúcich dĺžku ľudského života.

Ilustračné foto. Zdroj: iStockphoto.com
Kde je skrytý kľúč na dlhovekosť a spomalenie starnutia?
Výskumy týkajúce sa predlžovania ľudského života sa v posledných rokoch zameriavajú na všetky podnety, ktoré stimulujú ľudské telo už na bunkovej úrovni tak, aby sa stalo silnejším a odolnejším. Dlhovekí Japonci výrazne menej trpia chronickými chorobami vrátane rakoviny, infarktov, mozgových príhod a demencie. Japonskí seniori dosahujú dlhovekosť vďaka pozitívnym stimulom aktivujúcim ich gény dlhovekosti. Neraz ide o kombináciu viacerých stimulov, akými sú zabezpečovanie zdravej výživy založenej na vlastnoručne pestovanej zelenine, strukovinách a čerstvých morských rybách, pravidelnom pohybe na čerstvom vzduchu a udržiavanie častých sociálnych kontaktov s rodinou a priateľmi.
O epigenóme (súbore chemických modifikácií DNA a proteínov spojených s DNA v bunke, ktoré menia génovú expresiu) je známe, že je ovplyvnený vonkajšími faktormi, predovšetkým stravou a intenzívnym pohybom. Vďaka tomu sú správna výživa a aj pravidelné prechádzky dôležitými kandidátmi na zabezpečenie dlhovekosti.
Potraviny si treba nielen správne vyberať, ale ich konzumáciu náležite obmedzovať
Vedci zistili, že obmedzenie príjmu potravy myší o 60 percent viedlo k predĺženiu ich života o 30 percent. Účinky zníženia konzumácie potravy a predĺženia života boli už dávno pozorované v prípade mnohých druhov vrátane primátov. Na myšacích modeloch sa ukázalo, že hladovanie samíc viedlo k zníženiu množstva pridávania epigenetických značiek – metylových skupín na DNA –, a tým pozitívnej regulácie expresie génov hrajúcich úlohu pri dlhovekosti. Diétne obmedzenie nielenže čiastočne chráni DNA pred epigenetickými metylačnými zmenami spôsobenými vekom, ale súčasne podnecuje preprogramovanie génov metabolizmu lipidov, čo zrejme vedie k prospešným zmenám, ktoré pomáhajú ľudskému organizmu lepšie fungovať. Fyziologické preprogramovanie metabolizmu lipidov spôsobené diétnym obmedzením chráni organizmy pred vekom podmieneným nárastom tukových usadenín v pečeni a rozvojom inzulínovej rezistencie pečene, čo je znakom cukrovky 2. typu.
Viete, že „zdravý“ krátkodobý stres odomyká potenciál dlhovekosti?
Ako sa vyššie uvádza, kľúč k dlhovekosti našli odborníci prekvapivo i v strese, ktorému podliehajú nielen jednotlivé bunky organizmu, ale aj organizmus ako celok. Dlhovekí Japonci svojím prístupom k životu potvrdili, že ľudské telo si vytvára dlhodobú odolnosť pri vystavovaní sa krátkodobému „zdravému“ stresu, ako je napríklad prerušovaný pôst, intenzívne cvičenie, stres vyvolaný teplom či chladom. Prirodzene nejde o chronický patogénny stres, ktorý človeku z dlhodobého hľadiska škodí. Primeraný stres je pre ľudský epigenóm blahodarný, pretože stimuluje expresiu génov dlhovekosti.
Tento proces „otužovania“ organizmu a z toho prameniaca stimulácia aktivity génov dlhovekosti sa odborne nazýva hormetickým efektom. V podstate ide o tézu, podľa ktorej pomáha malé množstvo toxických či inak stresujúcich látok stimulovať výkonnosť imunitnej sústavy a metabolizmu človeka. Významný austrálsky profesor genetiky David A. Sinclair, ktorý sa zaoberá výskumom starnutia a epigenetiky, vysvetľuje v knihe Lifespan Why We Age – and Why We Don’t Have (Dĺžka života, prečo starneme – a prečo nemusíme), že „zdravý“ krátkodobý stres podporuje „zdravie“ ľudských buniek a odomyká potenciál dlhovekosti, ktorý sa u ľudí evolučne vyvinul.
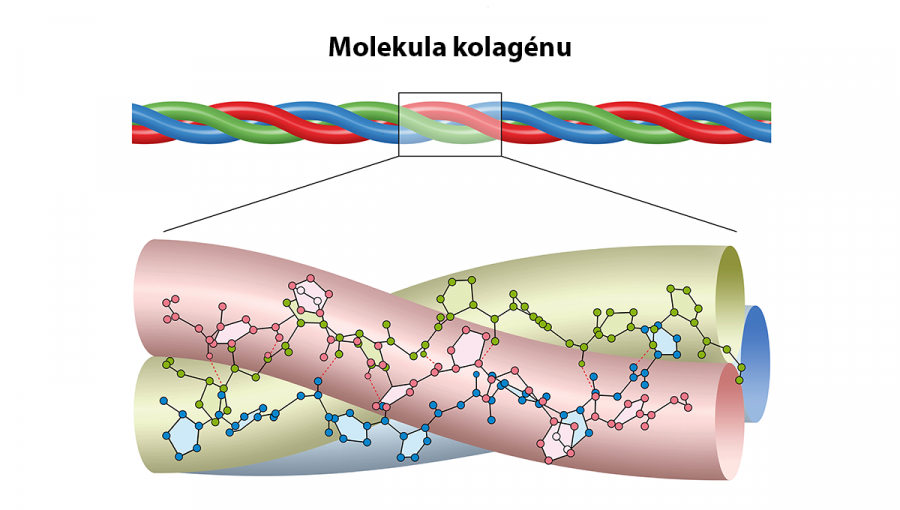
Molekula kolagénu. Zdroj: iStockphoto.com
Ovládajú už odborníci procesy súvisiace s omladzovaním kože?
Pri omladzovaní kože vedci z Univerzity v Cambridgei paradoxne použili postupy známe z výskumu realizovanom v Roslinovom inštitúte v Edinburgu a zavŕšenom narodením Dolly – prvej klonovanej ovečky. Vedcom z Cambridgeu sa podarilo omladiť bunky 53-ročnej ženy do podoby, ktorá zodpovedala bunkám 23-ročného človeka, a tak potvrdiť, že omladzovanie kožných buniek je dnes už realitou.
V experimentoch na myšiach simulujúcich kožnú ranu vystavili odborníci staršie myšacie bunky pôsobeniu chemických zlúčenín, ktoré ich preprogramovali tak, aby sa správali ako mladé bunky. Ukázalo sa, že preprogramované omladené bunky produkujú viac kolagénových bielkovín, a preto podstatne urýchľujú hojenie rán. Mohli by byť preto perspektívne využité v regeneratívnej medicíne.
Na záver sa autorka obracia nielen na seniorov, ale aj na ľudí, ktorí sa nachádzajú iba na polceste svojej životnej púte, aby sa čo najskôr začali riadiť základnými princípmi umožňujúcimi zdravé starnutie tak, aby sa všetci mohli cítiť aj v starobe mladými.
Zdroje: NCBI; Centrum aktívneho starnutia; Cirkadiánne rytmy; David Sinclair a Matthew D. Laplante: Lifespan – Why We Age – and Why We Don’t Have to