Vedcom sa podarilo rozlúštiť sofistikovaný opravný proces štruktúry DNA, čo je dôležité pri liečbe genetických porúch a život ohrozujúcich chorôb, ako je rakovina.
Poškodenie v genetickom reťazci. Zdroj: iStockphotos.com. Autor: Christoph Burgstedt
Spáleniny od slnka či starnúca pokožka sú na povrchu viditeľnými dôsledkami vystavenia sa škodlivému UV žiareniu, tabakovému dymu a iným karcinogénom. Účinky negatívnych vplyvov však nie sú len povrchové. Ako píše portál Phys, vnútri tela sa DNA doslova trhá na kusy.
Pochopenie toho, ako sa telo lieči a chráni pred poškodením DNA, je životne dôležité pri liečbe genetických porúch a život ohrozujúcich chorôb, ako je rakovina. Napriek mnohým štúdiám a pokrokom v medicíne zostáva veľa detailov o molekulárnych mechanizmoch opravy DNA záhadou.
Pri výskume pomohol superpočítač
Vedci zo Štátnej univerzity v Georgii využili superpočítač Summit v Oak Ridge National Laboratory ministerstva energetiky, aby analyzovali prepracovaný mechanizmus na opravu DNA nazývaný nukleotidová excízna reparácia (NER). NER sa spolieha na rad vysoko dynamických proteínových komplexov na vyrezanie poškodenej DNA s chirurgickou presnosťou.
Vo svojej štúdii publikovanej v Nature Communications vedecký tím uvádza, že pomocou modelovania odhalil kľúčovú úlohu proteínového komplexu PInC (pre-incision complex), ktorý reguluje proces opravy v neskorých fázach NER.
Dekódovanie sofistikovanej sekvencie opravného procesu NER a úloha PInC v tejto dráhe by mohli poskytnúť kľúčové poznatky k vývoji nových liečebných postupov a prevencii stavov, ktoré vedú k predčasnému starnutiu a k určitým typom rakoviny.
Všestranná cesta
„Zaujíma nás spôsob, ako bunky opravujú svoj genetický materiál,“ povedal vedúci výskumník Ivaylo Ivanov, profesor chémie na Štátnej univerzite v Georgii. „NER je všestranná cesta, ktorá opravuje všetky druhy rôznych poškodení DNA pomocou trojstupňového procesu, ktorý sa spolieha na jemne vyvážené molekulárne mechanizmy. Bohužiaľ, môžu sa vyvinúť škodlivé mutácie, ktoré zasahujú do tohto ,stroja‘ a spôsobujú vážne ľudské choroby,“ vysvetlil Ivanov.
„Účinky genetických mutácií sa však môžu nápadne líšiť v závislosti od ich pozícií v rámci opravných komplexov. V niektorých prípadoch mutácie vedú k tomu, že pacienti majú zvýšenú citlivosť na UV svetlo a extrémnu predispozíciu k rakovine. V iných prípadoch spôsobujú abnormálny vývoj a predčasné starnutie,“ uviedol Ivanov. „To, prečo sa to deje, nie je úplne pochopené na molekulárnej úrovni. To je záhada, ktorú sa pomocou počítačového modelovania snažíme odhaliť.“
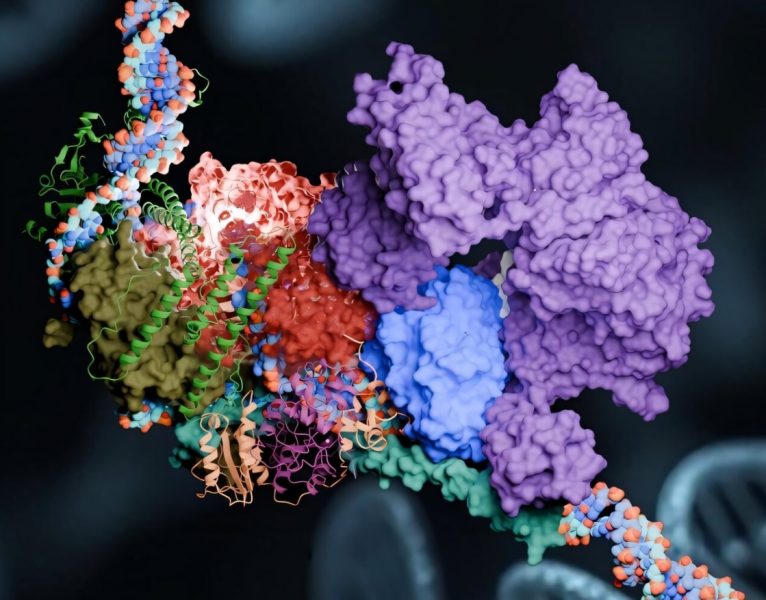
Proteínové zložky NER môžu meniť tvar a vykonávať rôzne funkcie opravy na zlomených vláknach DNA (modrá a červená špirála). Zdroj: Tanmoy Paul, Georgia State University
Tri fázy opravného mechanizmu
NER prebieha v troch fázach: rozpoznanie problematického úseku DNA, overovanie poškodenia a oprava. Každá fáza vyžaduje rôzne skupiny proteínov na vykonávanie špecifických funkcií, podobne ako traumatologický tím má rôznych špecialistov potrebných na liečbu zranených pacientov na pohotovosti.
V prvej fáze NER proteín XPC (xeroderma pigmentosum group C) lokalizuje miesto poškodenej DNA alebo lézie a potom skrúti špirálu DNA, aby bolo poškodenie prístupné. XPC potom privolá ďalšie opravné proteíny, aby pomohli iniciovať druhú fázu nazývanú overenie poškodenia alebo skenovanie lézií.
Tu sa proteínový mechanizmus NER posúva do svojej ďalšej podoby. Keď XPC ustúpi, na miesto poškodenia sa presunie proteínový komplex nazývaný transkripčný faktor IIH alebo TFIIH (číta sa T-F-2-H). TFIIH ďalej odvíja poškodenú časť DNA a skenuje novoodhalené vlákno na léziách.
V tretej fáze opravy nastupuje zákrok „chirurga“, proteínového komplexu PInC. Dva špecifické enzýmy XPF a XPG sa presne umiestnia na každú stranu lézie a pôsobia ako molekulárne nožnice na vyrezanie poškodeného segmentu DNA. Len čo je lézia odstránená, syntetizuje sa nová DNA, aby sa vyplnila medzera, ktorá zostala. Nakoniec sa reťazec DNA zapečatí a poškodená DNA je ozdravená.
Nové otázky
Vedci sa teraz snažia pochopiť, ako sa PInC tvorí po fáze skenovania lézií. V ďalšom výskume bude treba zodpovedať nové otázky: Ako je riadené umiestnenie dvoch enzýmových podjednotiek, ktoré vykonávajú dvojitý rez poškodeného reťazca DNA? Prebieha medzi týmito dvoma enzýmami vzájomná komunikácia?
Poznatky o štruktúre PInC sú kľúčové, pretože hneď ako je poškodené vlákno DNA naštiepené, je nevyhnutné, aby bol proces opravy dokončený vyplnením tejto medzery. V opačnom prípade to povedie k bunkovej smrti alebo k zavedeniu dvojvláknových zlomov, ktoré sú pre bunku mimoriadne škodlivé.
Na prekonanie tejto výzvy vedci použili model založený na neurónovej sieti s názvom AlphaFold2 na predpovedanie neznámych štruktúr a rozhraní medzi proteínmi, ktoré držia PInC pohromade. „Keď už výpočtovo zostavíte PInC, simulácie molekulárnej dynamiky komplexu sa stanú relatívne jednoduchými, najmä na veľkých superpočítačoch, ako je Summit,“ povedal Ivanov.
Zložité výpočty
Nanoscale Molecular Dynamics (NAMD) je kód molekulárnej dynamiky špeciálne navrhnutý pre superpočítače a používa sa na simuláciu pohybov a interakcií veľkých biomolekulárnych systémov, ktoré obsahujú milióny atómov. Pomocou NAMD výskumný tím vykonal rozsiahle simulácie. Sila superpočítača Summit s kapacitou 200 petaflopov – schopného vykonať 200 000 biliónov výpočtov za sekundu – bola nevyhnutná pri odhaľovaní funkčnej dynamiky komplexu PInC v časovom rozsahu mikrosekúnd.
Simulácie vedcov ukázali veľa o zložitej povahe PInC. „Teraz oveľa lepšie rozumieme tomu, ako a odkiaľ sa genetické poruchy prejavujú,“ dodal Ivanov.
Zdroj: Nature Communications, Phys
(LDS)







