Za objavom mechanizmu utlmenia génov v terapii stojí aj šľachtenie petúnií.
Molekula mikro RNA. Zdroj: iStockphoto.com
Objav RNA interferencie, čiže utlmenia génov, priniesol nový spôsob, ako ovplyvniť ich hladinu v bunke bez toho, aby bolo nutné pozmeniť jej DNA. Za približne tridsať rokov sa RNA interferencia stala zo zaujímavého fenoménu perspektívnou novou liečbou viacerých typov ochorení vrátane nádorových.
RNA môže vykonávať viac funkcií
V jadre každej bunky je uložená celá jej genetická informácia v podobe DNA, ktorá predstavuje návod na stavbu bielkovín. Podľa poradia nukleotidov (základných stavebných kameňov DNA) spája bunka jednotlivé aminokyseliny a skladá z nich potrebné bielkoviny. Prenos informácie z DNA do bielkoviny neprebieha priamo, ale za pomoci ďalšieho typu nukleovej kyseliny – RNA, konkrétne mediátorovej RNA (mRNA).
DNA a RNA sú si z hľadiska chemickej štruktúry podobné, no malé odlišnosti medzi nimi majú zásadný význam pre ich funkciu. DNA je stabilnejšia, a preto vhodnejšia na uchovávanie informácií o tom, ako poskladať z bielkovín bunky či celý organizmus.
Výhodou RNA je schopnosť vytvárať komplexnejšie štruktúry, a vykonávať tak v bunke viac funkcií. Jednou z nich je už spomenutý prenos informácie z DNA do bielkoviny pomocou mRNA, ktorá je preto známa aj ako kódujúca RNA. Ďalšie funkcie sú vykonávané cez nekódujúcu RNA. Na jej základe nie sú vytvárané bielkoviny, ale plnia iné špecifické úlohy. Upravujú prepísanú mRNA, napomáhajú pri tvorbe bielkovín z DNA (translácia) a taktiež sa zapájajú do jej regulácie.
Ako utlmiť gény
Štúdie publikované v deväťdesiatych rokoch minulého storočia ukázali prekvapivý jav – keď bola do bunky vložená sekvencia RNA, prípadne DNA pre určitý gén, jeho hladina sa v bunke zrazu znížila.
Jav pozorovali prvýkrát na rastlinách, konkrétne pri šľachtení petúnií. Vedci chceli získať intenzívnejšie sfarbenie kvetov, a preto sa rozhodli vložiť do buniek DNA sekvenciu génu pre syntézu fialového farbiva. Na ich prekvapenie mali však niektoré kvety svetlé škvrny, prípadne boli celé biele. Na prvý pohľad neúspešný experiment stál na začiatku objavu nového spôsobu regulácie expresie génov, ktorý dostal názov RNA interferencia. Regulačné mechanizmy sú dôležité preto, aby dochádzalo k správnej expresii génov, čiže vyjadreniu genetickej informácie do finálneho produktu.
O niekoľko rokov neskôr popísal tím z Carnegiho inštitútu vo Washingtone podrobný mechanizmus ďalšieho modelového organizmu – hlístice háďatka obyčajného (Caenorhabditis elegans). Profesori Andrew Zachary Fire a Craig Mello – dvaja členovia tímu – získali potom za svoj objav v roku 2006 Nobelovu cenu za fyziológiu alebo medicínu.
Dve tváre RNA interferencie – siRNA a miRNA
RNA interferencia nie je obmedzená len na nukleové kyseliny, ktoré do buniek prechádzajú z vonkajšieho prostredia. Existujú viaceré skupiny nekódujúcich RNA, ktorých funkcia je založená na mechanizme RNA interferencie. V prípade rastlín je dominantná krátka interferujúca RNA (short interfering RNA, siRNA), ktorá je úplne komplementárna k svojej cieľovej mRNA (všetky nukleové bázy siRNA sa párujú k bázam väzobného miesta na mRNA). Po naviazaní siRNA je cieľová mRNA zničená a nevytvára sa z nej bielkovina.
Z krátkych nekódujúcich RNA prevažujú v prípade živočíchov najmä mikroRNA (miRNA), ktorých objav je tiež spojený s výskumom realizovaným na háďatkách. Z hľadiska mechanizmu funkcie sa miRNA od siRNA vo viacerých aspektoch líšia. miRNA je len čiastočne komplementárna k cieľovej mRNA. S tým úzko súvisí aj fakt, že jedna miRNA sa môže viazať na mRNA pre viaceré gény. Čiastočná komplementarita je taktiež spojená s tým, že cieľový gén nemusí byť po naviazaní miRNA zničený, len sa zastaví jeho preklad do sekvencie aminokyselín v proteíne (translácia).
Mnohé vedecké práce v posledných desaťročiach ukázali, že RNA interferencia nezohráva úlohu len pri vývoji háďatka. Významne sa podieľa aj na regulácii expresie génov človeka. Predpokladá sa totiž, že takmer dve tretiny génov sú regulované prostredníctvom miRNA.
Výskumníci zistili, že miRNA je spojená aj so vznikom rôznych ochorení. Tím pod vedením profesora Carla Maria Croce z Univerzity Thomasa Jeffersona vo Filadefii ukázal, že gény pre miRNA – miR-15 a miR-16 – sa nachádzajú v špecifickom úseku na ľudskom chromozóme 13, ktorý často chýba u pacientov trpiacich chronickou lymfatickou leukémiou. V ich nádorovom tkanive pozorovali vedci zníženú hladinu spomínaných miRNA. Uvedený objav otvoril dvere k hľadaniu prepojenia zmien hladiny miRNA so vznikom a rozvojom ochorení.
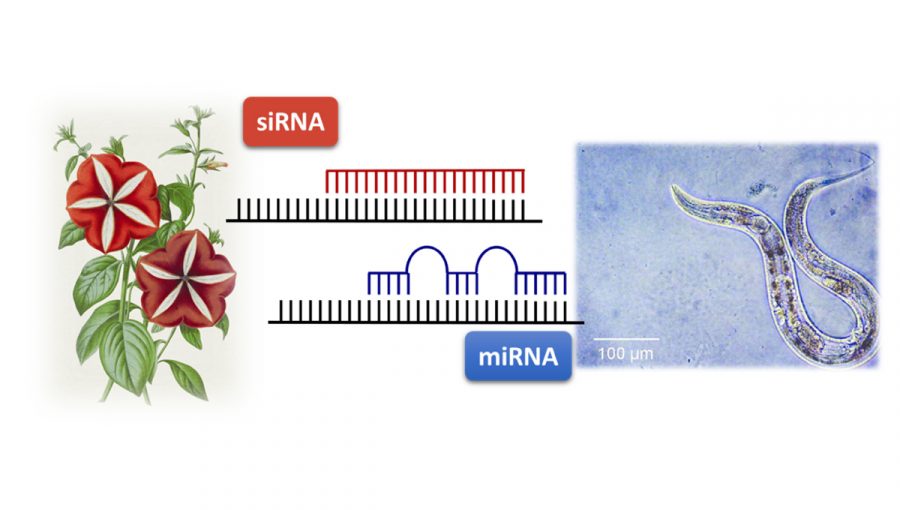
Malé nekódujúce RNA, ktoré regulujú expresiu génov prostredníctvom RNA interferencie. V prípade rastlín (na obrázku petúnia) sú to krátke interferujúce RNA (siRNA) s úplne komplementárnym reťazcom k cieľovej mRNA. V prípade živočíchov (na obrázku C. elegans) sú to mikro RNA (miRNA), ktoré sú len čiastočne komplementárne k svojej cieľovej mRNA. Zdroj: archív PP
Ako využiť miRNA pri liečbe?
Veľké množstvo prác ukázalo súvis medzi zmenenými hladinami miRNA v tkanivách alebo v telesných tekutinách a prítomnosťou ochorení. Výskumníci sa preto začali venovať myšlienke využitia miRNA nielen v diagnostike ochorení, ale aj pri ich liečbe.
Hladiny miRNA možno ovplyvniť priamym dodaním synteticky vytvorených molekúl konkrétnej miRNA – miRNA mimic. Druhou možnosťou je použitie miRNA inhibítora – vlákna s opačnou sekvenciou (antisense) –, ktorý sa naviaže na vybranú miRNA a zabráni jej reagovať s cieľovými génmi.
Prvým krokom liečby je výber vhodnej miRNA pre optimálny účinok terapie. miRNA regulujú zvyčajne väčší počet génov, čo môže byť výhodné, pretože pri liečbe nádorového ochorenia môžeme ovplyvniť signálnu dráhu génu, a tak utlmiť rast buniek v nádore. Liečba pomocou miRNA prináša aj väčšie riziko nežiaducich vedľajších účinkov. Prvým z nich je ovplyvnenie génov, ktoré nechceme. Ďalším môže byť nadmerná aktivácia imunitného systému. Z tohto dôvodu musela byť zastavená aj druhá fáza klinického skúšania liečiva MRX34, ktoré slúži na liečbu pevných nádorov lokalizovaných v obličkách, pečeni či pľúcach.
Aby sa nežiaduce účinky liečiva čo najviac znížili, je podstatné nastaviť ich tak, aby pôsobili v konkrétnom orgáne. Pri systémovom podaní do celého organizmu, napríklad vnútrožilovo, vieme úspešne zacieliť na receptory špecifické pre dané tkanivo. Na zacielenie liečiva do pečene sa používa sacharid N-acetylgalaktozamín. Ďalšími látkami, ktoré sa využívajú, sú transferín (bielkovina z krvi napomáhajúca transportu železa) a folát, pretože ich receptory sa vo zvýšenej miere nachádzajú v niektorých typoch nádoroch.
Dizajn a testovanie nových liečiv, založených na miRNA, je zatiaľ len na začiatku. Výskumníci chcú do budúcnosti presnejšie popísať účinky miRNA v jednotlivých tkanivách a stanoviť ich prepojenie s rozvojom ochorenia.
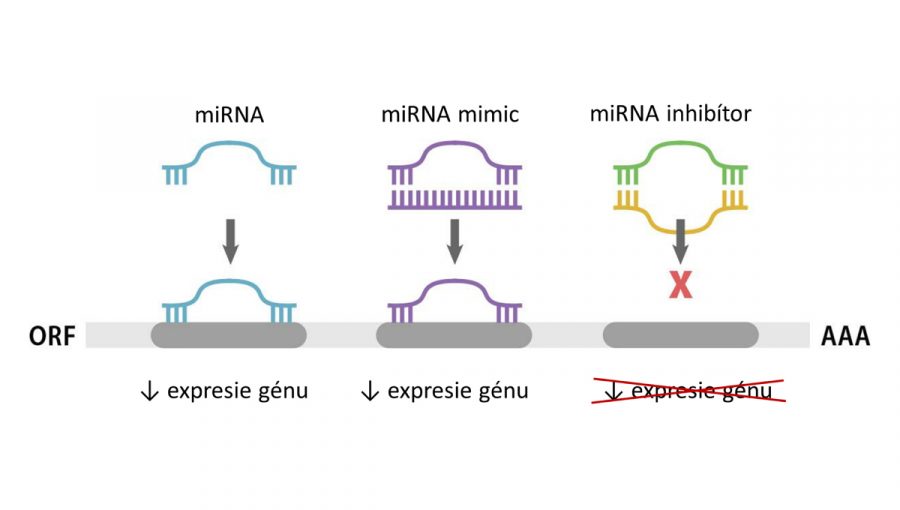
Vplyv miRNA, miRNA mimic a miRNA inhibítora na expresiu cieľového génu. Zdroj: ABM
Transport miRNA
Aby bola terapia pomocou miRNA čo najúčinnejšia, musia vedci vybrať vhodný transportér, ktorý stabilizuje miRNA a pomôže jej prejsť cez membránu bunky, keďže samotné vlákno RNA ňou neprejde.
Transportné systémy môžeme na základe ich zloženia rozdeliť do troch kategórií – lipidové, polymérové a anorganické. Základom lipidových transportérov (napríklad lipozómy a micely) je lipidová dvojvrstva, ktorá obalí miRNA. Vďaka tomu je nielen chránená pred degradáciou (rozpadom), ale prestupuje tiež ľahšie cez membránu bunky.
Lipozómy sa často využívajú ako transportné médium, napríklad aj pri spomínanom liečive MIRX34, ktoré bolo ako prvé založené na báze miRNA a zaradené do klinického skúšania. Medzi lipidové transportéry patrí taktiež cholesterol, ktorý je významnou súčasťou bunkovej membrány. Súčasťou lieku Remlarsen je miR-29b mimic, ktorý využíva na svoj transport väzbu s cholesterolom.
Ďalšími zaužívanými transportérmi sú dendriméry, ktoré dostali svoje pomenovanie podľa rozvetvenej štruktúry podobnej stromu. Sú zložené z polymerizujúcich molekúl, napríklad polyamidoamínov (PAMAM) alebo polypropylénimínov (PPI), ktoré vzájomne polymerizujú, čím vytvárajú viaceré vrstvy vetvenia a symetrickú štruktúru.
Polymérové nanočastice môžu byť vytvárané aj z polyméru kyseliny mliečnej (PLGA) alebo chitosanu (odvodený z chitínu, ktorý tvorí vonkajšiu kostru hmyzu).
Stabilita miRNA
K zvýšeniu stability miRNA a jej úspešnému prestupu do bunky prispieva okrem vhodného transportéra i jej samotná úprava. Pripojením metylových alebo fosfátových skupín sa zvýši jej odolnosť voči enzýmom, ktoré ju štiepia a narúšajú. Vedci upravujú aj celkový elektrický náboj liečiva, aby mohlo do bunky čo najjednoduchšie vstúpiť. Modifikujú miRNA tiež tak, že vytvoria takzvané zamknuté nukleové kyseliny (LNA, Locked nucleic acid). Pri ich vytváraní pridajú do molekuly RNA ďalšiu chemickú väzbu, vďaka ktorej sa miRNA stabilizuje a enzýmy ju nemôžu štiepiť.
Vybrané liečivá založené na miRNA, ktoré sa dostali do klinického skúšania
- Miravirsen
Miravirsen je prvý liek, ktorý bol založený na miRNA a dostal sa do klinického testovania na ľuďoch. Prvá fáza klinického testovania sa začala v roku 2012 a bola založená na princípe inhibície miR-122, na ktorú sa viaže vírus spôsobujúci hepatitídu typu C. Klinické testovanie, ktoré sa konalo aj na Slovensku, ukázalo, že podávanie Miravirsenu viedlo k zníženiu množstva vírusu u pacientov.
- MRX34
Je založený na báze miR-34a-5p mimic a vyvíjali ho na viaceré typy pevných nádorov lokalizovaných v obličkách, pečeni či pľúcach. Počas druhej fázy klinického skúšania vedci v súvislosti s imunitným systémom zistili vážne nežiaduce účinky, preto ho napokon stiahli.
- TargomiRs
Jedným z komponentov liečiva TargomiRs je miRNA – mimic miR-16, určený pre pacientov s malígnym pleurálnym mezoteliómom. V prvej fáze klinických testov sa ukázalo, že spomalil rast nádoru a pacienti ho dobre tolerovali.
- Cobomarsen (MRG-106)
Liečivo je založené na inhibícii (potlačení) miR-155 a používa sa u pacientov s niektorými typmi lymfómov a leukémie. Klinické testovanie ukázalo, že ho pacienti znášajú dobre a zároveň spomalil rast nádorov. V roku 2020 ho vládna agentúra USA zodpovedajúca za kontrolu liečiv (FDA) zaradila do kategórie liečiv na liečbu zriedkavých ochorení.
- Lademirsen (RG-012)
Lademirsen inhibuje miR-21, čím znižuje fibrotické zmeny u pacientov s Alportovým syndrómom – ochorenie spôsobené mutáciou v géne pre kolagén typu štyri, ktoré vedie k fibróze a následnému poškodeniu obličiek. Liek prešiel do druhej fázy klinického skúšania, ktorá bola však v priebehu júla tohto roka (2022) predčasne ukončená.
- Remlarsen (MRG-201)
Liečia sa ním viaceré fibrotické ochorenia vrátane idiopatickej pľúcnej fibrózy a patologickej fibrózy kože. V súčasnosti je v druhej fáze klinického skúšania.
Výskum miRNA na Slovensku
Štúdiom miRNA sa zaoberá tím profesorky Ivety Herichovej z Katedry živočíšnej fyziológie a etológie Prírodovedeckej fakulty Univerzity Komenského v Bratislave, ktorého súčasťou je aj doktorandka Paulína Pidíková. Spoločne skúmajú zmeny hladín miRNA v tkanive nádoru a ich účinok na rozvoj kolorektálneho karcinómu.
Kolorektálny karcinóm je nádorové ochorenie hrubého čreva a konečníka, ktoré je veľmi rozšírené najmä v rozvinutých krajinách vrátane Slovenska. V rámci nádorových ochorení je kolorektálny karcinóm na popredných priečkach aj z hľadiska úmrtnosti pacientov.
V ďalšom článku vám priblížime problematiku kolorektálneho karcinómu, doterajšie výsledky a pozorovania vedkýň z Prírodovedeckej fakulty.
Autor: Paulína Pidíková, PRIF UK
Zdroje: DOI: 10.1038/s41573-021-00219-z
DOI: 10.2147/DDDT.S288859
DOI: 10.1016/j.addr.2022.114113
DOI: 10.1016/j.jare.2020.08.012
DOI: 10.1186/s41544-019-0024-y
DOI: 10.1186/s41544-019-0024-y
(JM)