Navrhnutá metóda, nazvaná PPIformer, umožňuje predpovedať účinky molekulových zmien v zlomku sekundy.
Robotická ruka aplikuje liečivo. Zdroj: iStockphoto.com
Výskum bioterapeutík predstavuje sľubný prístup k liečbe závažných ochorení. Hlavnou zložkou sú biologické látky, ako napríklad proteíny, ktoré sú upravené tak, aby sa zamerali na konkrétne aspekty choroby. Významný prínos v tejto oblasti, hlavne v liečbe cievnej mozgovej príhody, sa podaril našim českým susedom.
Ich nová metóda s názvom PPIformer využíva strojové učenie na efektívnejší návrh proteínov s vylepšenými interakčnými vlastnosťami, čím sa otvára cesta k výraznému urýchleniu vývoja nových liekov proti mozgovej mŕtvici aj na liečbu ďalších ochorení. Výsledky výskumu vedci prezentovali na jednej z najvýznamnejších svetových konferencií strojového učenia ICLR 2024 začiatkom mája vo Viedni.
Liečenie trombofilných stavov
Bioterapeutiká môžu na rozdiel od tradičných liekov spolupracovať s imunitným systémom alebo inými biologickými procesmi, a tým rozpoznať a liečiť chorobu. Sú nimi často enzýmy, protilátky alebo dokonca bunky, ktoré si však vyžadujú úpravu na zlepšenie biologickej účinnosti a stability.
Vedci sa zamerali na vývoj vylepšenej verzie proteínu stafylokinázy, ktorý sa už osvedčil pri rozpúšťaní krvných zrazenín v trombolytických liečivách podávaných pri mozgovej mŕtvici. Mŕtvica môže mať závažné a dlhodobé následky vrátane ochrnutia, problémov s rečou a jazykom, straty pamäti a emočných ťažkostí. Jej vplyvy sa môžu značne líšiť v závislosti od závažnosti mŕtvice a rýchlosti poskytnutej liečby. Široké klinické použitie stafylokinázy je ale v súčasnej dobe limitované jej slabou interakciou s plazmínom, proteínom prítomným v ľudskej krvi.
Stafylokináza je enzým, ktorý je produkovaný baktériami zo skupiny stafylokokov. Zasahuje do procesu zrážania krvi – vďaka aktivácii plazminogénu na plazmín pomáha rozpúšťať krvné zrazeniny.
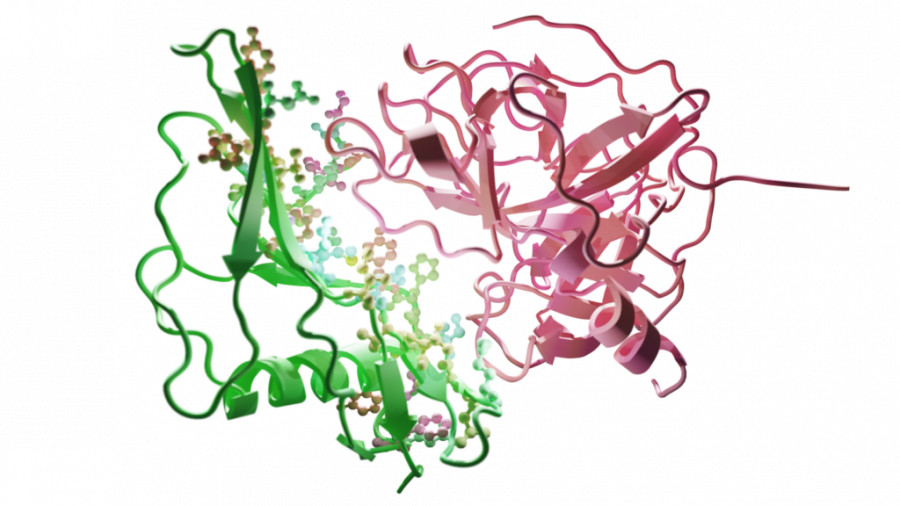
Interakcia biologickej molekuly stafylokinázy (vľavo/zelená) s proteínom plazmínom (vpravo/červená) prítomným v ľudskej krvi. Aminokyseliny stafylokinázy zodpovedné za interakciu sú znázornené malými guľôčkami v rôznych farbách. Zdroj: ČVUT
Predpovedanie zmien na základe strojového učenia
„Zamerali sme sa na vylepšenie stafylokinázy pomocou výmeny jej špecifických stavebných kameňov – aminokyselín, ktoré sú zodpovedné za tieto interakcie,“ vysvetľuje Josef Šivic z Českého inštitútu informatiky, robotiky a kybernetiky Českého vysokého učenia technického v Prahe (CIIRC ČVUT). „Aby sme identifikovali aminokyseliny najvhodnejšie pre také nahradenie, natrénovali sme výpočet schopný sa učiť z veľkého množstva príkladov, podobne ako je to už bežné v iných odboroch, napríklad pri spracovaní prirodzeného jazyka systémy, ako sú ChatGPT. Systém dokáže predpovedať účinok takej zmeny, teda ako zmeny v aminokyselinách následne ovplyvnia interakcie medzi proteínmi,” dodáva.
Existujú milióny možných spôsobov, ako modifikovať aminokyseliny bielkovín. „Tradičný spôsob nájdenia tých najvhodnejších úprav na zlepšenie interakcie liečiva by vyžadoval rozsiahle a časovo náročné experimenty,“ upozorňuje Tomáš Pluskal z Ústavu organickej chémie a biochémie Akadémie vied Českej republiky (ÚOCHB AVČR). Identifikácia týchto zmien aminokyselín má veľký praktický význam aj pre ďalšie úlohy súvisiace s interakciou proteínov, napríklad pre návrh nových vakcín a biosenzorov.
Dokáže predpovedať účinky v zlomku sekundy
Navrhnutá metóda, nazvaná PPIformer, umožňuje predpovedať účinky aminokyselinových zámen na proteínovo-proteínové interakcie (PPI) v zlomku sekundy. Metóda PPIformer je založená na strojovom učení, ktoré implementuje takzvané self-supervised učenie, keď je model schopný sám sa učiť z dát bez nutnosti ďalších anotácií.
„To znamená, že PPIformer nevyžaduje nákladné a časovo náročné laboratórne experimenty. Namiesto toho sa spolieha na nami novozhromaždený a v súčasnosti najväčší súbor dát proteínovo-proteínových interakcií, získaných z verejne dostupných štruktúr proteínov,” objasňuje Stanislav Mazurenko z Loschmidtových laboratórií Masarykovej univerzity v Brne.
PPIformer bol najprv trénovaný na predpovedanie aminokyselín zamaskovaných v známych štruktúrach proteínovo-proteínových interakcií. Princíp je podobný ako pri rozsiahlych jazykových modeloch, napríklad ChatGPT, ktoré sú trénované na predpovedanie slov vo vetách.

Vedci Jiří Sedlář, Peter Kouba, Roman Bushuiev, Anton Bushuiev, Josef Šivic (zľava doprava) z ČVUT na konferencii vo Viedni, 7. 5. 2024. Zdroj: ČVUT
Vyvinutá metóda preukázala vysoký potenciál pri identifikácii priaznivých mutácií v stafylokináze a tiež v ľudskej protilátke proti koronavírusu SARS-CoV-2.
Významný prínos urobil tím Josefa Šivica z CIIRC ČVUT, najmä vedci Anton a Roman Bushuievovci, v spolupráci s tímom Stanislava Mazurenka z Loschmidtových laboratórií Masarykovej univerzity v Brne a Medzinárodného centra klinického výskumu (ICRC) Tomáša Pluskala z ÚOCHB AV ČR.
Zdroj: ČVUT
(JM)






