Vedci sa pokúšajú napodobniť počiatky ľudského života, a to bez dvoch nevyhnutných zložiek: spermií a vajíčok.
Ilustračný obrázok. Zdroj: iStockphotos.com. Autor: Sefa kart
Výskum vo vývinovej biológii napreduje závratným tempom. Odborníci z oblasti umelých embryí a kmeňových buniek opisujú, v akom štádiu je vývoj laboratórne pripravených modelov embryí, kde sa nachádza, či sa postupne nezačína stierať hranica medzi laboratórnym modelom a skutočným embryom, ako sa naprieč krajinami líši legislatívny pohľad na problematiku, ale aj to, v čom vidia najväčšie obavy smerom do budúcnosti.
Vedci sa pokúšajú napodobniť počiatky ľudského života, a to bez dvoch nevyhnutných zložiek: spermií a vajíčok. Pomocou kmeňových buniek – programovateľných buniek, ktoré sa môžu premeniť na rôzne špecializované bunky v tele – sa im v laboratóriách darí vytvárať štruktúry, ktoré sa podobajú na ľudské embryá.
Obavy z pokroku modelovania
Tieto modely embryí nie sú síce zďaleka dokonalými kópiami, no sú čoraz zložitejšie a začínajú sa nielen podobať na skutočné embryá, ale sa aj správať ako ony. Laboratóriá po celom svete medzi sebou súťažia, komu sa podarí vytvoriť najvernejší model.
Modely embryí by mohli pomôcť lepšie pochopiť vývin človeka aj príčiny neplodnosti. Výskum napreduje závratným tempom a keďže celé toto odvetvie existuje len niečo vyše desiatich rokov, naráža na množstvo etických, právnych i regulačných noriem.
„Nikto z nás netušil, že veda sa posunie tak rýchlo. Je to neuveriteľný, úplne prelomový krok,“ hovorí profesorka Amander Clarková z Kalifornskej univerzity v Los Angeles, odborníčka na bunkovú a vývinovú biológiu a zakladateľka Centra pre reprodukčnú vedu, zdravie a vzdelávanie. „S napredovaním modelov je zároveň nesmierne dôležité, aby sa skúmali v medziach, ktoré vyvážia vedecký pokrok s etickými, právnymi a so spoločenskými otázkami.“
Mohli by sme sa dočkať modelu, ktorému by tĺklo srdce alebo ktorý by dokázal cítiť bolesť? A čo ak by bolo možné takýto model ďalej vyvíjať až do podoby plne vyvinutého ľudského jedinca?

Replika modelu ľudského embrya vytlačená 3D tlačou ako súčasť výstavy Inštitútu Francisa Cricka na letnej vedeckej výstave Kráľovskej spoločnosti v Londýne v júli 2024. Replika je približne 500-krát väčšia ako skutočný model embrya s veľkosťou 0,3 milimetra. Zdroj: Stephen Potvin
Do akej miery sú realistické?
Podľa súčasného stavu výskumu zatiaľ neexistuje žiadny model, ktorý by úplne napodobňoval vývin ľudského embrya. A zatiaľ sa nepredpokladá, že by mal ktorýkoľvek z nich potenciál vyvinúť sa do štádia plodu, teda do fázy, ktorá v tehotenstve zodpovedá približne 8. týždňu (56. dňu).
Vytváranie podobných modelov je navyše nie veľmi úspešné. Väčšine výskumných tímov sa darí len zriedkavo. Iba malá časť kmeňových buniek sa spontánne zorganizuje do štruktúr, ktoré pripomínajú embryo. Momentálne je tento proces skôr experimentovaním než exaktnou vedou.
Napriek tomu však modely vykazujú niekoľko vnútorných znakov a typov buniek, ktoré sú nevyhnutné pre vývin embrya. Ide napríklad o amnión (vnútorný plodový obal), žĺtkový vak či tzv. primitívny prúžok, ktorý je základom vzniku chrbtice. Podľa štúdie, na ktorej sa autorsky spolupodieľala aj profesorka A. Clarková a ktorá vyšla v odbornom časopise Stem Cell Reports, by sa tieto štruktúry – pri ďalšom zlepšení technológie – mohli v budúcnosti vyvíjať ďalej až po embryonálne základy srdca, mozgu a iných orgánov. Podobné modely vytvorené z myších buniek už dokonca dosiahli štádium, v ktorom sa začína vyvíjať mozog a formovať srdce.
Je zásadné pochopiť, že cieľom výskumu nie je vytvárať životaschopné plody alebo bytosti schopné ľudského vedomia. Zámerom je vytvoriť účinný výskumný nástroj, ktorý pomôže odhaliť, ako sa z jednej ľudskej bunky stane celé telo – teda ako sa bunka delí, špecializuje a spolupracuje s ostatnými bunkami v prvotných fázach vývinu.
Modely tiež vytvárajú priestor na experimenty, ktoré by bolo nemožné (alebo eticky neprípustné) vykonávať na darovaných ľudských embryách v laboratóriu.
Napriek tomu, ako výskum napreduje, hrozí, že sa hranica medzi laboratórnym modelom a skutočným ľudským embryom začne stierať. A práve preto, ako upozorňuje profesorka Clarková, si táto práca vyžaduje oveľa dôslednejší dohľad než iné vedecké disciplíny. Modely embryí totiž ležia na pomedzí dvoch historicky citlivých oblastí: výskumu kmeňových buniek a embryológie.
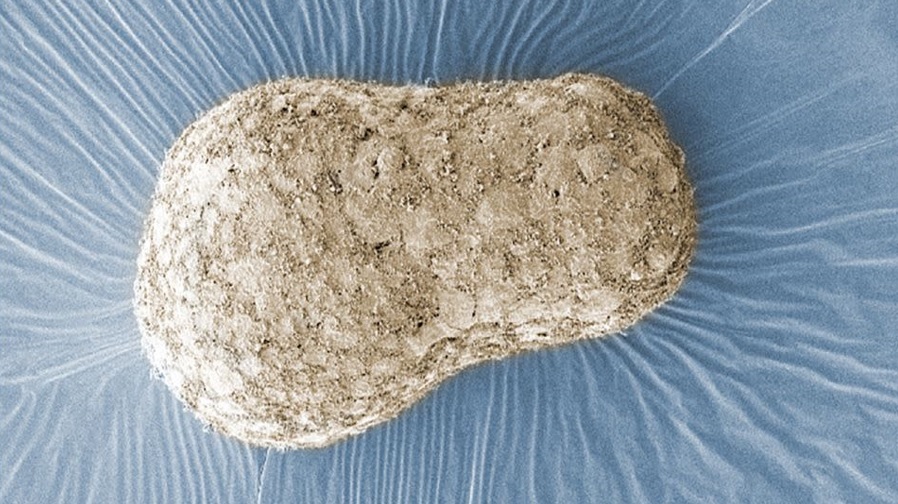
Obrázok modelu ľudského embrya, ktorý vyvinula výskumníčka Naomi Morisová z Inštitútu Francisa Cricka v Londýne. Zhotovený bol technikou nazývanou skenovacia elektrónová mikroskopia a zobrazuje zhluk buniek v troch rozmeroch.
Zdroj: Naomi Morisová
Sprísnenie legislatívy
V polovici júna Clarková spolu s pracovnou skupinou Medzinárodnej spoločnosti pre výskum kmeňových buniek (ISSCR) špecializujúcou sa na modely embryí odporučili sprísniť dohľad nad výskumom, ktorý sa týka týchto modelov. ISSCR zaradila do svojich etických smerníc už v roku 2021 prvé usmernenia súvisiace s modelmi embryí, no teraz ich prepracováva a aktualizovanú verziu plánuje zverejniť v najbližších týždňoch.
Smernice ISSCR doposiaľ rozlišovali medzi tzv. integrovanými modelmi embryí, ktoré napodobňujú celé embryo (vrátane podporných štruktúr, ako sú žĺtkový vak či amnión), a neintegrovanými modelmi, ktoré kopírujú iba jeho časť. Prísnejšiu kontrolu vyžadovali najmä tie prvé.
Nové smernice však navrhujú jednotný prístup: všetok výskum zahŕňajúci modely embryí bez ohľadu na typ by mal prechádzať primeraným etickým a vedeckým posúdením. Cieľom je zabezpečiť, aby sa vedecký pokrok uberal zodpovedným smerom a aby sa zabránilo prekročeniu hraníc, ktoré by mohla spoločnosť považovať za neetické.
Navrhovaná aktualizácia smerníc tiež stanoví dve červené čiary, ktoré vedci nesmú prekročiť.
- Prvá platí už dnes: súčasné pravidlá výslovne zakazujú prenášať ľudské modely embryí do maternice, či už ľudskej, alebo zvieracej. Inými slovami, nie je povolené implantovať takéto modely do živého organizmu, aby sa ďalej vyvíjali.
- Druhá novinka: aktualizované smernice budú odporúčať, aby vedci nepoužívali ľudské modely embryí na výskum tzv. ektogenézy – teda vývinu embrya mimo tela ženy pomocou umelých materníc. Nebude teda eticky prijateľné snažiť sa vytvoriť život „úplne od nuly“ v laboratórnych podmienkach.
Dohľad nad modelmi embryí sa v jednotlivých krajinách líši. Zatiaľ najprísnejší postoj zvolila Austrália. Laboratórne vytvorené modely embryí zaradila do rovnakého regulačného rámca, aký platí pre prácu so skutočnými ľudskými embryami. Znamená to, že na výskum s modelmi je potrebné získať špeciálne povolenie. Rovnako je to aj pri práci s reálnymi embryami vytvorenými napríklad pri umelom oplodnení.
V Holandsku sa pred dvomi rokmi objavil návrh, aby sa „neštandardné” embryá – modely embryí vytvorené z kmeňových buniek – považovali pred zákonom za rovnocenné ľudským. Vo Veľkej Británii zas vedci v roku 2024 zverejnili dobrovoľný etický kódex, ktorým sa majú riadiť výskumné tímy. Aj Japonsko vydalo nové smernice, ktoré upravujú výskum v tejto oblasti. Nejde síce o zákon, ale o oficiálne pravidlá. V USA zatiaľ pre modely embryí neexistuje jednotný právny rámec, každý výskumný návrh posudzujú samostatne jednotlivé inštitúcie a organizácie, ktoré poskytujú financovanie.
Ani Slovensko nie je výnimkou. Podľa Zákona o zdravotnej starostlivosti (č. 576/2004 Z. z.) je výskum na embryonálnych kmeňových bunkách a embryách, ako aj tzv. terapeutické klonovanie a vytváranie embryí s výskumným zámerom zakázané. Povolený je len výskum na dospelých (somatických) kmeňových bunkách alebo napríklad na indukovaných pluripotentných kmeňových bunkách (iPSC), ktoré sa získavajú z tela dospelých osôb.
Zatiaľ len málo krajín uvažuje o tom, že by pre modely embryí prijali špeciálne zákony. Aj preto sa medzinárodné smernice, ktoré vydáva ISSCR (Medzinárodná spoločnosť pre výskum kmeňových buniek), stávajú mimoriadne dôležitým referenčným bodom pre výskumníkov na celom svete a sú kľúčové na to, aby sa zabránilo výskumu, ktorý by nespĺňal najvyššie etické a vedecké štandardy.
Paralela s diamantmi
Podľa profesorky Clarkovej by sa mali modely embryí vytvorené z kmeňových buniek odlišovať od výskumu so skutočnými ľudskými embryami. Ide zvyčajne o prebytočné embryá, ktoré pochádzajú z procedúr umelého oplodnenia (IVF) a darujú sa na vedecké účely. Takýto výskum s reálnymi embryami je v mnohých krajinách prísne regulovaný a napríklad v Nemecku, Rakúsku či Taliansku úplne zakázaný.
Aj profesorka Emma Caveová, odborníčka na zdravotnícke právo z Durhamskej univerzity vo Veľkej Británii, ktorá sa špecializuje práve na právne otázky modelov embryí, súhlasí s tým, že je rozumné – aspoň nateraz – pristupovať k modelom a reálnym embryám rozdielne. Používa pritom zaujímavé prirovnanie: prírodné diamanty a ich laboratórne vyrobené imitácie majú rovnaké chemické zloženie, no spoločnosť im pripisuje odlišnú hodnotu.
Caveová však zároveň upozorňuje, že by sme sa nemali unáhliť s príliš prísnymi reguláciami modelov embryí, mohli by totiž zabrzdiť výskum, ktorý má potenciál priniesť prelomové poznatky o ľudskom vývine, plodnosti a liečbe ochorení. „Sme ešte len na začiatku vývoja týchto modelov,“ hovorí Caveová. „Je možné, že o päť, možno dvadsať rokov sa budú veľmi podobať na ľudské embryo. A možno sa na tú úroveň ani nikdy nedostanú.“
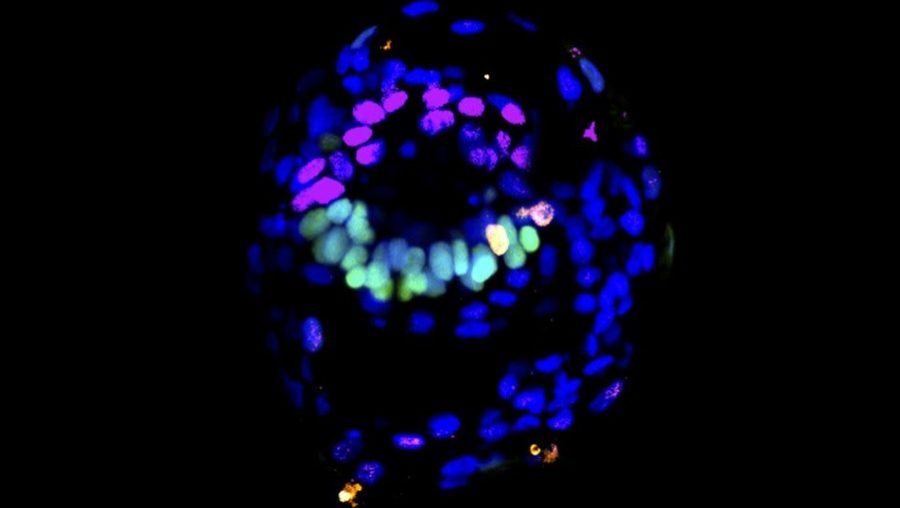
Štruktúra podobná ľudskému embryu vytvorená z preprogramovaných kmeňových buniek. Budúce somatické bunky sú sfarbené na zeleno a amnión je znázornený ružovou farbou, pričom sa tvorí na opačných stranách a oddeľuje ho amniotická dutina. Zdroj: Laboratórium Weatherbee a Gantner/Zernicka-Goet
Turingov test embryonálnych modelov
Podľa Naomi Morisovej z výskumného inštitútu Francisa Cricka je pre regulačné orgány najväčšou výzvou určiť, kedy (a či vôbec) sa laboratórne modely embrya stanú funkčne rovnocenné skutočnému ľudskému embryu. V takom prípade by im mala prináležať rovnaká alebo podobná právna a etická ochrana. Jediný definitívny test by mohol preniesť takýto model do maternice náhradnej matky, čo je ale dnes zakázané.
Morisová však patrí do skupiny výskumníkov, ktorí navrhli dva kľúčové „body zlomu“ alebo tzv. Turingove testy. Tie sú inšpirované spôsobom, akým zakladateľ modernej informatiky Alan Turing určil, či stroje dokážu myslieť ako ľudia. Slúžiť majú na vyhodnotenie, kedy sa už hranica medzi umelým modelom a reálnym ľudským embryom začína stierať.
„Je zrejmé, že tieto štruktúry momentálne nie sú embryá – nemajú rovnaké schopnosti ani vývinový potenciál ako skutočné embryo,“ povedala Morisová. „Ale ako budeme dopredu vedieť, že sa k tomu blížime? Práve na základe tejto logiky sme vytvorili Turingove testy, ktoré nám pomôžu určiť, aké kritériá alebo merania by sme mohli použiť ako ukazovatele potenciálu takého modelu.“
Prvý z navrhovaných testov by sledoval, či sa modely dajú spoľahlivo a opakovane vytvoriť a či sa vyvíjajú stabilne počas určitého obdobia, podobne ako normálne embryá. Druhý test by zas posúdil, kedy modely embryí zvieracích kmeňových buniek – najmä druhov najbližších človeku, ako sú opice – vykazujú potenciál vytvoriť živé a plodné jedince po prenose do náhradnej maternice. V teoretickej rovine by to mohlo znamenať, že niečo podobné je potenciálne možné i u ľudí.
Zatiaľ k tomu nedošlo, ale v roku 2023 čínski vedci vytvorili embryonálne modely z kmeňových buniek makakov, ktoré po implantovaní do maternice náhradnej opice vyvolali znaky skorého tehotenstva (napr. hormonálne zmeny a tvorbu placentárneho tkaniva). Tento výsledok síce nevyústil do skutočného plodu alebo jeho narodenia, avšak predstavuje prvý varovný signál, že výskum sa blíži k hraniciam, ktoré dosiaľ považujeme za eticky nedotknuteľné.
Tanec na tenkom ľade
Zástancovia tejto technológie tvrdia, že laboratórne vypestované modely embryí predstavujú rovnako hodnotnú a možno aj etickejšiu alternatívu k výskumu so skutočnými ľudskými embryami, ktoré sú vzácne a menej dostupnejšie. Na rozdiel od ľudských embryí, ktoré pochádzajú najčastejšie z darovaných nadbytočných embryí po umelom oplodnení, modely možno v laboratóriu vyrábať vo veľkom množstve.
Jednou z najsľubnejších aplikácií je testovanie liekov z hľadiska ich vplyvu na vývin embrya (tzv. embryotoxikológia), teda zistenie, či konkrétny liek alebo konkrétna chemická látka môže poškodiť embryo v ranom štádiu vývinu. Má to mimoriadny význam, pretože tehotné ženy boli historicky často vylučované z klinických štúdií z dôvodu obáv o ich bezpečnosť.
Potenciál použitia týchto modelov pri vytváraní života vyvoláva medzi bioetikmi obavy. Podľa A. Clarkovej už výskumné skupiny otvorene hovoria o možnosti vytvorenia embrya in vitro, teda skombinovaním rôznych bioinžinierskych prístupov. Ako uvádza v štúdii, považuje to za neetické a nebezpečné.
Profesorka E. Caveová považuje ektogenézu, t. j. proces vývinu embrya alebo plodu mimo tela matky, za nie až takú vzdialenú hudbu budúcnosti. Podľa jej slov by sa mohli tieto dve technológie spojiť s raketovým vývojom embryonálnych modelov a postupným výskumom umelých materníc. Na záver dodala: „Skutočnou výzvou bude rozpoznať hodnotu týchto výskumných smerov, ale zároveň zabrániť ich zneužitiu.“
S touto myšlienkou súhlasí aj Jun Wu, odborník na molekulárnu biológiu z Texaskej univerzity, ktorý patrí medzi popredných vedcov v oblasti kmeňových buniek. Aj on považuje ektogenézu za neprijateľnú. Ďalej hovorí, že výskumníci, ktorí vyvíjajú takéto modely, sa musia pohybovať na veľmi tenkej hranici. Na to, aby modely odhalili tajomstvá ľudského vývinu, musia byť embryám dostatočne podobné. Zároveň ale nemôžu byť príliš podobné, aby ich odborná verejnosť nezačala vnímať ako potenciálne životaschopné embryá.
Čierna skrinka ľudského vývinu
Magdalena Zernicka-Goetzová, profesorka biológie a biologického inžinierstva na Caltechu, uviedla, že nové smernice víta. Spolu s tímom sa jej v roku 2023 podarilo vypestovať modely, ktoré sa vývinovo podobali 14-dňovému ľudskému embryu. Profesor Jacob Hanna z Weizmannovho inštitútu v Izraeli zašiel ešte o krok ďalej. V rovnakom roku vytvoril jeho tím z kožných buniek model, ktorý obsahoval všetky typy buniek dôležité pre vývin embrya vrátane prekurzora placenty.
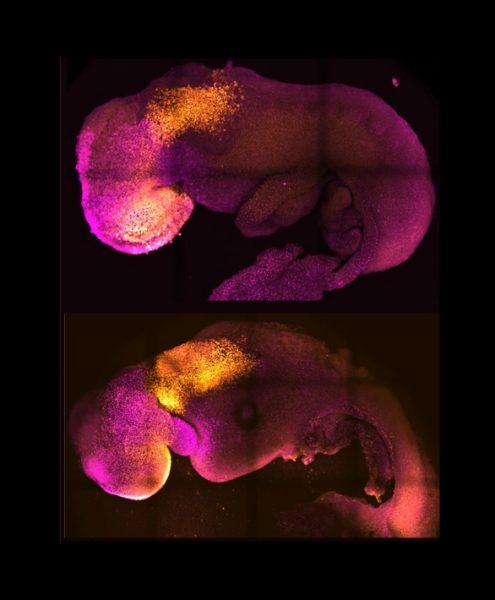
Prirodzené (hore) a umelo vypestované (dole) embryá vedľa seba, aby sa ukázala porovnateľná formácia mozgu a srdca. Zdroj: Amadei a Handford
„Tieto úspechy predstavujú zásadný prelom v potenciálnom využití modelov na výskum tehotenstva a samovoľných potratov. Práve okolo 14. dňa totiž dochádza k zahniezdeniu embrya do sliznice maternice, čo je známe pod pojmom implantácia,“ povedala Zernicka-Goetzová.
VEDOMOSTNÉ OKIENKO
Pomenovaním čierna skrinka sa tiež označuje proces, ktorého správanie poznáme, ale nevieme, ako presne funguje. V kontexte článku ním vedci pomenúvajú proces gastrulácie, najvýznamnejšej zo všetkých embryonálnych premien, ktoré nastáva približne 16 alebo 17 dní po oplodnení a viac ako týždeň po tom, ako sa voľne plávajúce embryo ukotví v endoteli maternice. V tomto vývinovom stupni sa začínajú formovať prvé známky centrálneho nervového systému a individuálnej identity embrya. Napriek tomu, aká je gastrulácia pre vývin človeka kľúčová, neexistuje žiadna štúdia o jej priamom pozorovaní, keďže prebieha hlboko vnútri maternice. Aj preto sú modely embryí z kmeňových buniek takým prelomom: umožňujú skúmať tento neviditeľný moment života po prvýkrát zblízka.
Laboratórny výskum ľudských embryí starších ako 14 dní vrátane embryí darovaných z IVF je vo väčšine jurisdikcií zakázaný. A hoci niektorí vedci študujú tkanivo získané z potratov, prístup k takýmto tkanivám je obmedzený, keďže potraty sa medzi 2. a 4. týždňom vývinu embrya vyskytujú zriedka.
Schopnosť pestovať embryonálny model mimo maternice v tomto vývinovom štádiu otvára cestu štúdiám, ktoré nemožno realizovať na živých ľudských embryách.
„V skutočnosti zlyhá omnoho viac tehotenstiev, než sa ich podarí, a to práve v tom najcitlivejšom období, čiže tesne pred uhniezdením embrya v maternici, počas neho a krátko po ňom. V mojom laboratóriu sme preto vytvorili embryonálne štruktúry z kmeňových buniek, aby sme skutočne pochopili toto kritické a veľmi krehké štádium vývinu,“ vysvetľuje vedkyňa.
Profesorka Amander Clarková súhlasí, že embryonálne modely by sa mohli potenciálne použiť na riešenie problémov s neplodnosťou. Na záver dodáva: „Uhniezdenie embrya je pre nás veľká neznáma. Keď sa embryo prichytí na stenu maternice, vieme o jeho ďalšom vývine len veľmi málo. A ak to nemôžeme skúmať, netušíme, čo všetko nám uniká.“
Zdroj: Clark et al. 2025, Cell, Quark, The Guardian, CNN (1, 2)
(LDS)