
Prečítajte si viac o vedcovi
V prírode sa nachádza asi 90 chemických prvkov, z ktorých mnohé ľudstvo pozná a využíva už od praveku. S použitím metód jadrovej fyziky bola v 20. a 21. storočí uskutočnená syntéza nových prvkov. Postupne to boli jadrové reaktory, skúšky termojadrových zbraní a napokon experimenty na urýchľovačoch ťažkých iónov. Vďaka nim bola v roku 2016 definitívne uzavretá siedma perióda Mendelejevovej tabuľky, ktorá v súčasnosti obsahuje 118 chemických prvkov.
Chemický prvok je látka, ktorá je tvorená atómami s rovnakým počtom protónov v atómovom jadre. Existujú izotopy daného prvku, sú to atómy alebo jadrá, ktoré majú rovnaký počet protónov, ale odlišný počet neutrónov. Najznámejší je urán (U). V prírode sa vyskytuje vo forme zmesi izotopov označovaných ako urán-238 a urán-235. Urán-235 sa štiepi a urán-238 sa neštiepi. Uránu-238 je v prírode veľa, uránu-235 zasa málo, preto musíme zvýšiť jeho koncentráciu. Hovorí sa tomu obohatenie. Keď koncentráciu uránu zvýšime na 2 %, môžeme spraviť elektráreň, ale ak sme ju zvýšili na 70 % tak z toho by sa dali vyrobiť jadrové zbrane. Existujú aj stabilné a rádioaktívne izotopy. Tie, ktoré sú rádioaktívne, sú nestabilné.
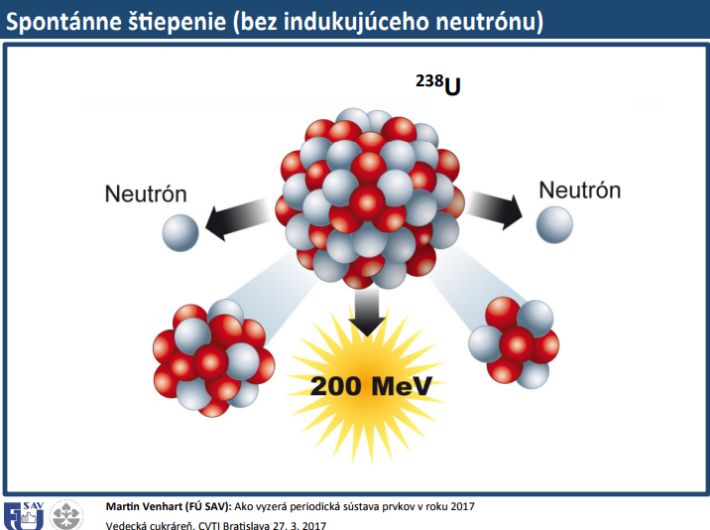
Rádioaktivita je samovoľná premena jedného atómového jadra na iné. Existuje niečo, čo sa podľa jazykovedcov nazýva doba polpremeny, predtým sa tomu hovorilo polčas rozpadu. Je to čas, za ktorý sa polovica atómov rozpadne, alebo sa zmení na iné. My tomu hovoríme, že sa rozpadne, preto to bol polčas rozpadu, jazykovedci chcú počuť, že sa premenia, čiže preto doba polpremeny. Keď budeme mať 100 jadier a prejde jeden polčas rozpadu, bude ich tam okolo 50.
Niektoré prvky sú tvorené jediným izotopom, napríklad zlato. Ak je v prsteni všetko zlaté, je to zlato označené číslom 197. Iné prvky sú zmesou izotopov. V kuse cínu sa nachádza až 10 stabilných izotopov. Každý jeden prvok má aj rádioaktívne izotopy. Sú prvky, ktoré majú len rádioaktívne, ale každý má aj rádioaktívne, a väčšinou sa v prírode nenachádzajú. Je to preto, že ich polčas rozpadu je oveľa kratší ako je vek Zeme. To znamená, že ak aj boli v prírode, už dávno sa rozpadli.
Príkladom známeho rádioaktívneho izotopu, ktorý je v prírode, je draslík-40. Jeho polčas rozpadu je 1 miliarda rokov, takže v prírode sa ešte stále nachádza. Veľa draslíka je napríklad v piesku. Keby sme v miestnosti postavili detektor gama žiarenia – a okolo je betón a v betóne je piesok – zistili by sme, že draslík-40 je všade naokolo a žiari na nás gama žiarenie. Nemožno sa ho zbaviť, je to prirodzené pozadie.
Hmotnostné, neutrónové a protónové číslo
Hmotnostné číslo uránu 238 uvádza, koľko nukleónov je v jadre. Nukleóny sú protóny a neutróny, čiže uvádza, koľko častíc dohromady je v jadre. Značka prvku je odvodená od latinského názvu daného prvku. Neutrónové číslo, ktoré hovorí, koľko je neutrónov v jadre. Protónové číslo uvádza počet protónov v jadre.
Z histórie modernej chémie
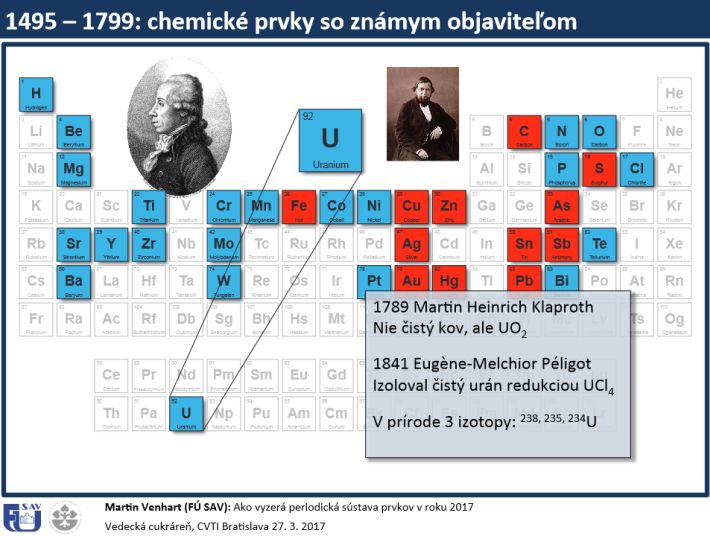
Otcom modernej chémie je Antoine Lavoisier, ktorý žil v 18. storočí a pre chémiu vykonal veľmi veľa. Je objaviteľom vodíka a kyslíka. Kyslík objavil nezávisle od britského chemika Priestleyho. Ako prvý vysvetlil úlohu kyslíka pri horení. Ukázal, že síra je v skutočnosti chemický prvok a nie je to zlúčenina, ako sa predpokladalo. Je jedným z autorov metrického systému a vôbec jeden z prvých, ktorí si uvedomovali, čo sú to chemické prvky. Zostavil jeden z prvých zoznamov chemických prvkov. Lavoisier za prvky považoval napríklad aj svetlo alebo teplo.
Druhým významným človekom pre chémiu je Dmitrij Ivanovič Mendeleev, ruský chemik, ktorý zostavil periodickú sústavu chemických prvkov. Ako prvý formuloval periodický zákon, ktorý hovorí, že chemické vlastnosti prvkov sú periodickou funkciou protónového čísla, čiže periodicky sa opakujú s rastúcim periodickým číslom a preto má jeho periodická tabuľka periódy a skupiny. Prvky, ktoré sú v skupinách, sa chemicky veľmi podobajú.
V GSI Darmstadt po roku 1989 začali pracovať vedeckí pracovníci Štefan Šáro a Rudolf Janík z Fakulty matematiky, fyziky a informatiky (FMFI) Univerzity Komenského v Bratislave. Navrhli a skonštruovali Time-of-Flight detektor, ktorý sa používa dodnes. Na Fakulte matematiky, fyziky a informatiky Univerzity Komenského v Bratislave pracovala pod vedením prof. Šára skupina, ktorej členmi boli doktorandi: Martin Veselský, Peter Cagarda, Ivan Brida, Stano Antalic, Braňo Štreicher a Martin Venhart.
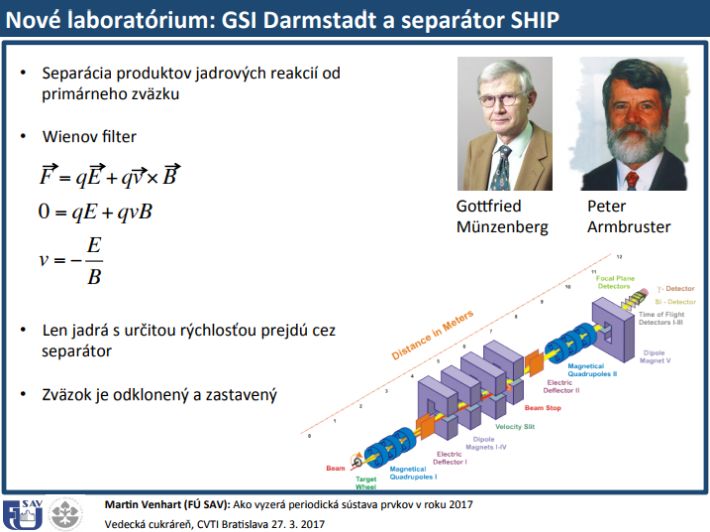
Slovenskí fyzici boli aj súčasťou medzinárodného tímu, ktorému sa podaril objav 57 nových izotopov. Vedecký kolektív zložený z odborníkov z dvanástich štátov realizoval experiment štiepenia izotopu uránu 238 na spektrometre fragmentov FRS v nemeckom laboratóriu GSI Darmstadt. Objav nových izotopov má veľký význam pre jadrovú astrofyziku, kde pomôže pri objasnení vzniku prvkov pri výbuchoch hviezd vo vesmíre a aj pri vývoji nových zdrojov energie – reaktorov, v ktorých sa izotop uránu 238 štiepi rýchlymi neutrónmi. Významným prínosom nových reaktorov môže byť energetické využitie terajšieho jadrového odpadu a jeho recyklácia na podstatne menej nebezpečný materiál.

S prednáškou na tému Objavy nových chemických prvkov vystúpil v Bratislavskej vedeckej cukrárni Mgr. Martin Venhart, PhD., z Fyzikálneho ústavu Slovenskej akadémie vied.
 Mgr. Martin Venhart, PhD., vedúci Oddelenia jadrovej fyziky Fyzikálneho ústavu SAV, venuje sa experimentálnej jadrovej fyzike, štúdiu deformácie atómových jadier a štruktúre hmoty tvoriacej atómové jadro. V roku 2011 navrhol prvý slovenský experiment v CERN-e: IS521 na urýchľovači ISOLDE. Následne viedol tím Slovenskej akadémie vied, ktorý na tento účel skonštruoval spektrometer TATRA a realizoval úspešné merania v CERN-e v rokoch 2014 a 2016. Vedie tiež experimentálny program štúdia štruktúry jadier zlata v cyklotrónových laboratóriách na Univerzite v Jyväskylä vo Fínsku a v iThemba Labs v Južnej Afrike.
Mgr. Martin Venhart, PhD., vedúci Oddelenia jadrovej fyziky Fyzikálneho ústavu SAV, venuje sa experimentálnej jadrovej fyzike, štúdiu deformácie atómových jadier a štruktúre hmoty tvoriacej atómové jadro. V roku 2011 navrhol prvý slovenský experiment v CERN-e: IS521 na urýchľovači ISOLDE. Následne viedol tím Slovenskej akadémie vied, ktorý na tento účel skonštruoval spektrometer TATRA a realizoval úspešné merania v CERN-e v rokoch 2014 a 2016. Vedie tiež experimentálny program štúdia štruktúry jadier zlata v cyklotrónových laboratóriách na Univerzite v Jyväskylä vo Fínsku a v iThemba Labs v Južnej Afrike.
Z prednášky spracovala a uverejnila: Marta Bartošovičová, NCP VaT pri CVTI SR
Foto: NCP VaT pri CVTI SR
Ilustrácie sú z prezentácie Mgr. Martina Venharta, PhD.



