
Prečítajte si viac o vedkyni
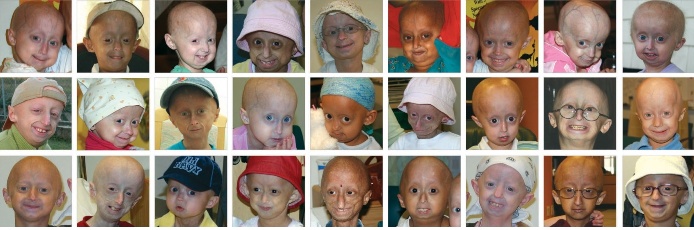
Starnutie je prirodzený proces každého človeka. V určitých prípadoch sa na nežnej tváričke bábätka môžu po ôsmych až desiatich mesiacoch od narodenia objaviť vrásky a celá jeho tvárička sa zmení na nepoznanie, pretože pripomína vráskami zbrázdenú tvár starca. Na vine je zriedkavá genetická porucha – progéria.
Čo je progéria?
Je to veľmi vzácna, dosiaľ nevyliečiteľná, geneticky podmienená choroba, ktorá sa vyskytuje vo frekvencii 1 postihnuté dieťa pripadajúce na 4 – 8 miliónov novonarodených detí. Spôsobuje predčasné starnutie celého tela novorodenca, ktorý obyčajne od ôsmeho mesiaca prestane rásť a priberať. Jeho telesný vývoj sa jednoducho zastaví. Dieťa si však zachováva (detskému veku) primeraný motorický a mentálny vývoj. Keďže mozog nie je zasiahnutý, malý pacient si uvedomuje svoju „inakosť“. Postihnuté dieťa starne 10-krát rýchlejšie ako zdravé. Preto jeho výzor často pripomína starých ľudí, ktorí sa dožili veku 80-tich rokov. Choroba sa častejšie vyskytuje u chlapčekov než u dievčatiek. Starecký výzor chorých detičiek žiaľ sprevádzajú aj typické starecké choroby, ako sú artritída, reuma, zlyhávanie obličiek alebo ateroskleróza, pričom malí pacienti trpia veľkými bolesťami. Postihnuté deti sa často v bolestiach dožívajú okolo 12 – 15 rokov. Väčšinou umierajú na infarkt myokardu alebo mozgovú mŕtvicu.
Dve formy predčasného starnutia
Progériu po prvý raz opísali nezávisle na sebe dvaja anglickí lekári – chirurgovia. V roku 1886 to bol Jonathan Hutchinson a v roku 1897 Hastings Gilford. Slovo progéria pochádza z gréckeho slova „progeros“, t. j. „predčasne starý“. Grécke slovo „pro“ znamená „pred“ a „geras“ znamená „staroba“. Ako prvý ho v roku 1904 oficiálne použil H. Gilford. Postihnutí jedinci majú niekoľko dôležitých spoločných znakov: sú drobní; majú krehkú telesnú konštitúciu; ich pehami pokryté tváre majú typický „vtáčí“ výzor s vypuklými očami; tenké končatiny chorých detičiek sú pokryté extrémne tenkou kožou a okrem toho, že nemajú dostatok telesného tuku a chýbajú im svaly, taktiež veľmi skoro strácajú vlasy, mihalnice a obočie. Progéria sa môže vyskytovať v dvoch formách, a to ako Hutchinsonov-Gilfordov syndróm alebo Wernerov syndróm.
Pravá progéria
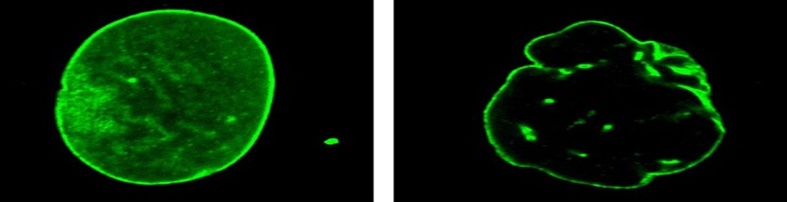
Klasická, resp. pravá progéria je najťažšou formou progérie a odborne sa nazýva podľa anglických lekárov, ktorí progériu koncom 19. storočia po prvý raz opísali – Hutchinsonov-Gilfordov syndróm (HGPS). U chorých detičiek sa začína prejavovať starnutie tvorbou vrások, plešatosťou (hneď po narodení), hromadením hyalurónovej kyseliny v moči. Postihnutý jedinec umiera ešte pred dovŕšením dvadsiatich rokov, preto diagnóze HGPS prischlo aj pomenovanie detská progéria. Až do roku 2003 nebolo známe, čo spôsobuje strašnú chorobu, pri ktorej sa deti výzorom stávajú starými ľuďmi. V článku uverejnenom v časopise Nature, bola progéria charakterizovaná ako „de novo dominantný znak“, ktorý vzniká počas bunkového delenia v ranom štádiu embryonálneho vývoja. Spoluautorkou článku bola aj doktorka Leslie Gordon, u ktorej syna bola vo veku 22 mesiacov diagnostikovaná progéria. Príčinou HGPS je sporadická bodová mutácia v géne LMNA (umiestnenom na 1. chromozóme/autozóme človeka), ktorá sa nededí, pretože jej nositelia umierajú skôr, ako by mohli mať vlastné deti. V prípade podozrenia na HGPS je možné túto diagnózu potvrdiť genetickým testovaním na prítomnosť mutácie LMNA. Epidemiologické štúdie odhalili, že dosiaľ boli potvrdené len dva výnimočné prípady výskytu tejto mutácie aj u zdravých nositeľov, ktorí ju preniesli na svoje deti, a to jedna indická a jedna belgická rodina. Nemutantná/štandardná forma génu LMNA zodpovedá za syntézu proteínu – lamínu A. Ten sa podieľa spolu s lamínom C na udržiavaní správnej štruktúry bunkových jadier. Dôsledkom mutácie v určitom úseku génu LMNA je zmena jeho expresie vedúca k tvorbe zvláštnej formy lamínu A (cez tzv. prelamín A) až k tzv. progerínu, ktorý spôsobuje narušenie tvaru a štruktúry (tzv. jadrového skeletu) a funkcií (syntéza RNA a DNA) bunkových jadier. Bunky sa delia nesprávne, rýchlo starnú, čo zabraňuje obnovovaniu tkanív a v konečnom dôsledku vedie k urýchleniu patologického starnutia celého organizmu.
Je metóda CRISPR/Cas9 novou nádejou pre liečbu progérie?
HGPS je zatiaľ neliečiteľnou diagnózou. Sľubnou cestou na potenciálnu liečbu tejto zriedkavej geneticky podmienenej choroby sú pokusy na myšiach, u ktorých sa pomocou metódy CRISPR/Cas9 podarilo znížiť produkciu progerínu narušením/elimináciou expresie mutovaného úseku génu LMNA zodpovedného za syntézu progerínu. Výsledky výskumu publikovaného v časopise Nature Medicine v roku 2019 by mohli významne ovplyvniť úsilie liečby tejto dosiaľ neliečiteľnej fatálnej choroby dieťaťa.
Progéria dospelých
Menej závažnou formou progérie je Wernerov syndróm (WS), respektíve progéria dospelých alebo pangéria. Pri tejto diagnóze začína predčasné starnutie koncom puberty alebo začiatkom stredného veku a končí sa smrťou, obyčajne v dospelosti pred dosiahnutím päťdesiatky. U pacientov s WS sa často vyskytuje cukrovka, hypertenzia, osteoporóza, strata svalovej hmoty, infarkt myokardu alebo rakovina. Priemerný vek pacientov, u ktorých bol práve diagnostikovaný WS, je 37 rokov. Vo svete sa WS vyskytuje sporadicky, a to 1 prípad na 100 000 pôrodov. Prekvapujúco sa najčastejšie vyskytuje v Japonsku a to v pomere 1: 20 000. Wernerov syndróm získal svoje pomenovanie podľa nemeckého vedca Otta Wernera, ktorý identifikoval WS u štyroch súrodencov v rámci jeho dizertačnej práce. WS je spôsobený recesívnou mutáciou génu WRN (lokalizovanom na 8 chromozóme/autozóme človeka), ktorý kóduje proteín/enzým DNA helikázu zapojenú do procesov opravy poškodenej DNA. Produkt tohto génu sa tiež podieľa na zabezpečení stability telomér (koncových častí chromozómov, ktoré ich chránia pred poškodením a degradáciou), čo je jednou zo základných požiadaviek pre zachovanie genómovej stability. (Poznámka: Teloméry sa považujú za dôležité markery starnutia, pretože ich dĺžka „kopíruje“ počet bunkových delení). Zlyhaním opravných procesov dochádza ku tzv. genómovej nestabilite, pri ktorej sa aktivujú enzýmy – tzv. stresové kinázy. Nestabilita sa manifestuje predčasným starnutím postihnutého jedinca. Stresové enzýmy spôsobujú, že napr. kožné fibroblasty pacientov s WS vykazujú charakteristické znaky pre bunky nachádzajúce sa v strese (spomalený rast, predĺžený bunkový cyklus a zmenený tvar). Najnovšie výskumy ukázali, že k patogenéze WS prispievajú aj epigenetické zmeny (napr. demetylácia) histónov.
Vedci sa snažia experimentálne dosiahnuť inaktiváciu stresových kináz využitím ich inhibítorov. Výsledky experimentov na myšiach dávajú nádej, že by sa v budúcnosti mohli inhibítory stresových kináz využiť na potenciálnu terapiu pacientov s WS.
Zriedkavá genetická porucha – progéria ako model pre výskum prirodzeného starnutia
Ľudstvo už oddávna sprevádza túžba uchovať si čo najdlhšie najkrajšiu etapu života – mladosť, spomaliť starnutie a dožiť sa čo najvyššieho veku. Otvorene si však treba priznať, že o procesoch, ktoré vedú k starnutiu ľudského tela, ešte veľa nevieme. Odborníci sa preto snažia odhaliť príčiny/mechanizmy starnutia a hľadajú spôsoby na spomaľovanie starnutia. Existuje veľa dôvodov, prečo naše bunky, tkanivá a celé organizmy postupom času starnú a prestávajú náležite fungovať. V súčasnosti sa princípy a mechanizmy procesov starnutia vysvetľujú pomocou viacerých hypotéz, pričom neexistuje jedna univerzálna hypotéza starnutia. Pri skúmaní príčin starnutia buniek sa viacerí výskumníci zameriavajú na výskum tzv. senescentných – opotrebovaných, starších buniek, ktoré už nefungujú/nereplikujú sa tak, ako by mali a navyše ohrozujú aj funkciu okolitých buniek. Ukázalo sa, že odstránenie takýchto starých dysfunkčných buniek zlepšuje mnohé parametre starnutia u experimentálnych zvierat. Bunky človeka sú jednoducho naprogramované tak, aby mali obmedzenú životnosť. Napriek tomu, že ešte stále existuje viac názorov, prečo sa bunky stávajú senescentnými, t. j. starnú, vedci sa prikláňajú k predpokladu, že senescenciu spôsobuje poškodenie DNA a skracovanie ochranných štruktúr na konci chromozómov – telomér. Dôležitý dôkaz o vzťahu medzi dĺžkou telomér a starnutím vzišiel zo štúdií pacientov trpiacich na progériu, ktorú charakterizuje predčasné starnutie (senescencia) celého organizmu. Práve preto Wernerov a Hutchinsonov-Gilfordov syndróm zaujali odborníkov, ktorí veria, že obidve zriedkavé diagnózy by im mohli poskytnúť základné indície o príčinách procesov vedúcich aj k prirodzenému starnutiu. V súčasnom období vedci využívajú progériu ako model vhodný pre objasnenie mechanizmov normálneho ľudského starnutia. Zdá sa, že mechanizmy, ktoré spúšťajú predčasné starnutie, spúšťajú aj prirodzené starnutie človeka. Veď proces starnutia sa týka zvyšovania množstva porúch genetického materiálu nahromadených počas bunkového delenia a je dôsledkom genomickej nestability, ktorá je najcharakteristickejším znakom progérie. Napriek tomu, že dosiaľ neexistuje priamy dôkaz o tom, že skrátenie telomér spôsobuje starnutie, somatické bunky pacientov postihnutých progériou majú krátke teloméry.
Iná hypotéza sa zakladá na skutočnosti, že proteín progerín môže hrať úlohu aj pri normálnom starnutí človeka. V roku 2007 vedci zistili, že progerín v malom množstve produkujú aj bunky ľudí, ktorí netrpia na progériu. Poznatky publikované v roku 2010 v časopise Journal Cell Science podporujú predpoklad, že predčasná bunková senescencia je napr. v prípade HGPS výsledkom nesprávnej funkcie (dysfunkcie) telomér vyvolanej nadmernou akumuláciou progerínu v bunkách postihnutých jedincov, zatiaľ čo pri prirodzenom starnutí sa množstvo progerínu len postupne mierne zvyšuje.
Záverom možno konštatovať, že prirodzené starnutie je pre človeka nevyhnutný proces, ktorého podstatu zatiaľ nie sme schopní zastaviť, možno ho ale v budúcnosti dokážeme náležite regulovať.
Autor: prof. RNDr. Eva Miadoková, DrSc. pre redakciu Veda na dosah, Katedra genetiky Prírodovedeckej fakulty Univerzity Komenského v Bratislave
Foto: z archívu prof. RNDr. Evy Miadokovej, DrSc.
Ilustračné foto: Pixabay.com /geralt/
Redigovala a uverejnila: VČ









