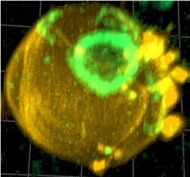
Na výskum v oblasti cytoskeletálnych proteínov a delenia buniek je zameraný projekt Regulačná sieť štruktúr vyššieho poriadku septínov (Regulatory network of septin higher-order structures). Zodpovedným riešiteľom je RNDr. Marian Farkašovský, CSc., Ústav molekulárnej biológie SAV.
Vysvetlil, že mikrotubuly, aktomyozínový kontrakčný kruh a septíny sú esenciálne cytoskeletálne komponenty zapojené v bunkovom delení. „Septíny sú guanín nukleotid viažuce proteíny, ktoré sa nachádzajú vo väčšine eukaryotov. Tieto proteíny sú esenciálne pre mnohé bunkové procesy, ako sú cytokinéza, remodelovanie membrán a slúžia ako konštrukcia na lokalizáciu asociovaných proteínov. Základnou jednotkou septínového komplexu v kvasinkách Saccharomyces cerevisiae je lineárny oktamér zložený zo štyroch rôznych podjednotiek (Cdc11-Cdc12-Cdc3-Cdc10-Cdc10-Cdc3-Cdc12-Cdc11). Skladaním oktamérových jednotiek prostredníctvom koncových Cdc11 septínov vzniká in vitro aj in vivo filament.“
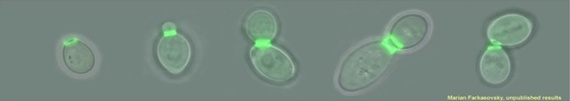
Septíny podľa odborníka tvoria v kvasinkách komplexné štruktúry vyššieho poriadku v krčku púčika, ktoré sa menia v závislosti od štádia bunkového cyklu. „Rôznorodé proteíny sa podieľajú na kontrole organizácie septínov. Pochopenie vzťahu medzi tvorbou proteínových komplexov v určitom čase a bunkovom priestore a biologickou funkciou zostáva stredom záujmu v rôznych oblastiach biológie. Priestorová lokalizácia polymerizácie v určitom čase podmieňuje funkciu cytoskeletálnych proteínov. Septíny sú podstatne menej preskúmané než ostaní členovia cytoskeletonu ako tubulín a aktín. Mechanizmus tvorby a lokalizácie štruktúr vyššieho poriadku a regulácia skladania septínového prstenca sú komplikované pre štúdium a preto doteraz slabo pochopené,“ uviedol RNDr. Marian Farkašovský, CSc.
Hlavným cieľom realizačného tímu projektu je vysvetliť, ako vplývajú posttranslačné modifikácie, t. j. chemické modifikácie septínov, ako aj pomocné proteíny na reguláciu koordinovaného skladania septínov v rôznych štádiach bunkového cyklu. „Snažíme sa o to hlavne pomocou in vitro metód, pri ktorých používame jednotlivé izolované proteíny a pozorujeme pomocou mikroskopických metód, aký vplyv majú na polyméry septínov. Celé to ešte kombinujeme s lipidickými membránami vzhľadom na skutočnosť, že septíny sú naviazané v bunkách na cytoplazmatické membrány. Podarilo sa nám určiť vplyv dvoch pomocných proteínov, ktoré spôsobujú zosietenie septínových štruktúr, čo má za následok spevnenie septínového prstenca v bunke. Okrem toho sme popísali účinok troch proteínov, nazývaných proteín kinázy, ktoré modifikujú iné proteíny pridávaním fosfátových skupín.“
Dve z týchto proteín kináz spôsobujú podľa odborníka depolymerizáciu septínov, pod vplyvom tretej vznikajú zväzky dlhých filamentov. Ich dlhodobým cieľom je zreprodukovať niektoré procesy pri delení bunky in vitro, a tak pochopiť ako fungujú na molekulárnej úrovni. „Podarilo sa nám už vytvoriť septínový prstenec na povrchu lipozómu, ktorý má veľkosť zodpovedajúcu veľkosti kvasinkovej bunky. Účinnosť tvorby septínového prstenca je zatiaľ pomerne nízka, bude potrebné vytvoriť komplexnešie systémy, než sú tie, s ktorými pracujeme v súčasnosti, aby sme sa viac priblížili podmienkam, aké panujú v bunke.“
Tento projekt je síce zameraný na základný výskum v oblasti cytoskeletálnych proteínov a delenia buniek, avšak existujú významné aspekty, ktoré hovoria pre dôležitosť tejto problematiky v aplikačnej sfére, poznamenáva ešte RNDr. Marian Farkašovský, CSc. z Ústavu molekulárnej biológie SAV.
„Správne delenie buniek a prenos membrán sú esenciálne pre správne fungovanie nielen samotných buniek, ale aj organizmov. Preto poruchy v týchto procesoch môžu spôsobovať vážne ochorenia. Septíny sú spájané s rôznymi typmi rakoviny, ako sú napríklad leukémia (MLL), glioblastóm, renálny karcinóm, kolorektálny karcinóm a mnohé ďalšie. V niektorých neurodegeneratívnych ochoreniach a iných chorobách nervovej sústavy, ako sú neuralgická amyotrofia, Parkinsonova choroba, schizofrenia a bipolárna porucha, bola tiež preukázaná účasť septínov. Okrem toho sa zistilo, že septíny inhibujú rozširovanie patogénov v organizmoch pri infekčných ochoreniach.“
Úloha septínov pri onkogenéze je podľa RNDr. Mariana Farkašovského, CSc. komplexná. „Zvýšená expresia týchto proteínov môže spúšťať rast rakovinových buniek, na druhej strane niektoré izoformy napomáhajú apoptóze a fungujú ako tumor supresor proteíny. Zmenená expresia septínov je spôsobená mutáciou alebo aj chromosomálnou translokáciou. Podrobné pochopenie funkcie septínov na molekulárnej úrovni v kontexte bunkového cyklu, ako aj v rôznych typoch buniek je kľúčové pri určení cieľových proteínov a interakcií, nájdenie ktorých je dôležitým predpokladom pre vytváranie nových, špecifickejších liečiv a diagnostických markerov.“
Odborník ešte dodáva, že prvým úspechom na tomto poli je, že SEPT9 sa začal v súčasnej dobe používať ako biomarker na detekciu kolorektálneho karcinómu pomocou určenia prítomnosti metylovanej DNA tohoto génu v plazme.
Projekt Regulačná sieť štruktúr vyššieho poriadku septínov je realizovaný v období 1. 1. 2017 – 31. 12. 2019.
Informácie a foto poskytol: RNDr. Marian Farkašovský, CSc., Ústav molekulárnej biológie SAV
Spracovala: Slávka Cigáňová (Habrmanová), NCP VaT pri CVTI SR
Uverejnila: VČ


